Application Note FLIPR®蛍光イメージングプレートリーダーシステムで使用される
Ca2+感受性色素Fluo-3とFluo-4の比較
PDF版(英語)
はじめに
FLIPR®システムでは、蛍光を用いた細胞内カルシウムの測定には通常、可視スペクトル励起色素fluo-3、Calcium Green-1、Oregon Green 488 BAPTA-1を使用します。これらの色素はUV励起色素と比較して、サンプルやプラスチックの自家蛍光からの干渉が少なく、細胞の光損傷が少ないなどの利点がある。
上記のものに加えて、Molecular Probes社(オレゴン州ユージーン)は、可視光励起性カルシウムインジケーターを提供している。これらは主にカルシウムに対する解離定数や励起・発光スペクトルが異なる。しかしながら、より高感度で毒性の低い色素の探索が続けられている。Molecular Probesは最近、fluo-3類似体fluo-4の開発を報告した。この2つの色素の唯一の構造上の違いは、fluo-3の2つの塩素原子が、fluo-4では2つのフッ素原子に置き換わっていることである。fluo-4の利点は、蛍光出力が大きく、細胞への負荷が速く、低負荷濃度でも同等の蛍光シグナルが得られることである(BioProbes 28, May 1998)。
このアプリケーションノートでは、M1トランスフェクトCHO細胞にfluo- 3とfluo- 4を負荷して得られた結果を直接比較した。カルバコール活性化に対するカルシウム応答の測定にはFLIPRシステムを使用した。
材料と方法
セルと培養条件
ムスカリン性アセチルコリン受容体(M1)を安定的にトランスフェクトしたCHO-M1細胞はATCCから入手した(M1 WT3 - CRL1984)。セルは、10%FBS、2mMグルタミン、Pen/Strep、50μg/ml Geneticinを添加したHam's F-12培地で培養した。細胞はアッセイの前日に、底が透明な96ウェルマイクロプレート(96ウェルCostar)に50,000個/ウェル(100μl/ウェル)の濃度でプレーティングした。
セルへの色素導入
Fluo-3およびfluo-4(いずれもアセトキシメチル(AM)エステル、Molecular Probes社製)を、10%プルロン酸を加えた低水DMSO(モレキュラーシーブで精製)に溶解し、ストック濃度を1 mMとした。
セルは、fluo-3またはfluo-4を表1に示す濃度で含む通常の培養培地(上記参照)で色素負荷した。陰イオン交換タンパク質による色素の押し出しを防ぐため、ローディング培地には2.5 mMのプロベニシドを添加し、最適なpHを維持するために20 mMのHEPES(pH7.3)を加えた。fluo-3とfluo-4のローディング効果を比較するため、色素濃度とローディング時間を標準ローディング手順*(2 µM fluo-3、1.0時間ローディング)から変化させた。ローディング後、Labsystems Cellwash 4を用いて、20 mM HEPESおよび2.5 mM Probenicidを封じ込めたHBSSで細胞を3回洗浄した。最後の洗浄ステップの後、1ウェル当たり100μlのバッファーがマイクロプレートに残された。
この調査で定義された条件は、普遍的に最適というわけではない。最適な条件は特異性の用途に依存し、多くのFactor、例えばセルタイプ、レセプタータイプ、レセプターの発現状態、レセプターのカップリングなどに影響される。従って、アッセイにおいて高輝度シグナルを得るために、より高い色素濃度を適用する必要がある場合もある。
| 蛍光染料 | 集中 | 負荷時間 |
|---|---|---|
| fluo-3 | 2 µM | 0.5時間 |
| fluo-3* | 2 µM* | 1.0時間 |
| fluo-4 | 1 µM | 0.5時間 |
| fluo-4 | 1 µM | 1.0時間 |
| fluo-4 | 2 µM | 0.5時間 |
| fluo-4 | 2 µM | 1.0時間 |
表1:評価した負荷条件(* = 標準条件)。
アゴニストによるセル刺激
FLIPRシステムでは、50μlのアゴニストカルバコール(最終濃度の3倍)を、50μl/secの速度でセルプレートに添加した。ウェル内の最終濃度は以下の通りである: 2.5 µM、1.25 µM、625 nM、312 nM、156 nM、78 nM、39 nM、19 nM、10 nM。FLIPRシステムの露光時間は0.4秒、F-stopはF/2、レーザー出力は400mWに設定し、カルバコール添加前、添加中、添加後の蛍光の変化をモニターした。
結果
非搭載細胞のバックグラウンド(表2、コラム1)
非荷重細胞の平均バックグラウンドは約1,450カウントであった(n = 8)。これはプラスチックの自家蛍光と、主にフラビン補酵素FADとFMN:フラビン-アデニン-ジヌクレオチドとフラビン-モノヌクレオチドに由来する細胞の固有蛍光によるもので、その吸収/発光波長は約450/515 nmである(J. Histochem Cytochem 27:44 [1979]; J. Histochem Cytochem 27:36 [1979])。
負荷セルのバックグラウンド(表2、コラム2と3)
負荷細胞のバックグラウンドは、負荷条件の違いによって変化した。fluo-3またはfluo-4の負荷時間を0.5時間から1.0時間に長くすると、基底蛍光強度が増加した(基底カウントの増加で示される)。色素濃度を1μMから2μMに上げると、fluo-4の基底蛍光強度も増加した(fluo-3では試さなかった)。試験した条件では、驚くことではないが、基礎蛍光強度は色素濃度が高くなるにつれて、またローディング時間が長くなるにつれて増加した。
負荷細胞のバックグラウンド(表2、コラム2および3)
最高濃度のカルバコール2種類(1.25 µMと2.5 µM)は、カルシウム流出によって測定された細胞の最大刺激につながった。したがって、これら2つの飽和濃度のカルバコールで刺激したセルからの平均蛍光数を最大応答とした。
1μMのfluo-4に0.5時間暴露した細胞は、刺激時に基底蛍光を10,994カウント上回るロスト性シグナルを示した。インキュベーション時間を1.0時間に倍増し、濃度を2 µMにすると、シグナルは24,289カウントに有意に増加した。fluo-3の負荷時間を長くすると、刺激時のシグナルも高くなった(0.5時間:6525カウント、1.0時間:9765カウント)。
まとめると、色素濃度または負荷時間を増加させると、バックグラウンドと刺激されたシグナルの両方が増加した。
シグナルの誘導レベル(表2、コラム6)
刺激によるカルシウムの誘導レベルを推定するために、最大刺激された細胞の補正された応答(コラム5)を、非刺激、負荷細胞の補正されたバックグラウンド(コラム3)で割った。
0.5時間の負荷時間と1.0時間の負荷時間(色素濃度固定)を比較すると、fluo-3(2 µM)とfluo-4(1 µMと2 µM)は、より短い培養時間でより高い誘導を生じることがわかる(2.6→3.1 / 2.8→3.2 / 2.9→3.6)。
1 µMと2 µMのfluo-4(負荷時間は一定)に対する反応を比較すると、色素濃度が高いほど誘導の程度も高くなるようだ。
同じ負荷条件(2μM、0.5時間または1.0時間負荷の両方)でfluo-3とfluo-4を比較すると、fluo-4色素がより高い誘導をもたらすように見える。
DyeConcent.Loading time(1) 無負荷セル 背景(2) 負荷セル 背景(2) 無負荷セル 背景正解(1)(4) 刺激セル(5) 刺激セル正解(1)(6) 誘導レベル = (5)/(3)
| 染料 | コンセント | 負荷時間 | (1)負荷なしセル | (2) 搭載セル 背景 | (2) 無負荷セル 背景は(1)の通り | (4) 刺激細胞 | (5) 刺激されたセル 正解:(1) | (6) 誘導レベル=(5)/(3) |
|---|---|---|---|---|---|---|---|---|
| fluo-3 | 2 µM | 0.5時間 |
1,469 +/- 72 |
3,580 +/- 234 |
2,111 |
7,994 +/-532 |
6,525 | 3.1 |
| fluo-3* | 2 µM* | 1.0時間* |
1,469 +/- 72 |
5,158 +/- 310 |
3,689 |
11,234 +/- 994 |
9,765 | 2.6 |
| fluo-4 | 1 µM | 0.5時間 |
1,415 +/- 58 |
4,857 +/- 422 |
3,442 |
12,409 +/- 981 |
10,994 | 3.2 |
| fluo-4 | 1 µM | 1.0時間 |
1,458 +/- 69 |
7,355 +/- 485 |
5,897 |
17,721 +/- 1,360 |
16,263 | 2.8 |
| fluo-4 | 2 µM | 0.5時間 |
1,415 +/- 58 |
5,533 +/- 276 |
4,118 |
16,242 +/- 830 |
14,827 | 3.6 |
| fluo-4 | 2 µM | 1.0時間 |
1,458 +/- 69 |
9,909 +/- 741 |
8,451 |
25,747 +/- 1,814 |
24,289 | 2.9 |
表2:fluo-3(負荷時間可変)またはfluo-4(負荷時間および色素濃度可変)を負荷したCHO-M1。
(1)から(5)の列には蛍光数を示した。* 標準条件
(1)負荷していないセルとプラスチックからのバックグラウンド; n = 8
(2) 染料を負荷した、刺激していない細胞; n = 44
(3) 染料を負荷した未刺激細胞、バックグラウンド蛍光で補正。
(4) 最大刺激(1.25または2.5μMカルバコール)細胞; n = 8
(5) 最大(1.25または2.5μMカルバコール)刺激細胞、バックグラウンド補正後。
(6) 誘導レベル= (5)/(3)
用量反応曲線の比較
図1は、6つの異なる負荷条件について作成した用量反応曲線を示している(値は、各個々の条件の最大値に対するパーセンテージで表される)。予想されるように、応答曲線は近接しており、異なる色素も異なる負荷条件も、それらを有意に変化させない(したがって、対応するEC50値も変化せず、70~95 nMのままである)。
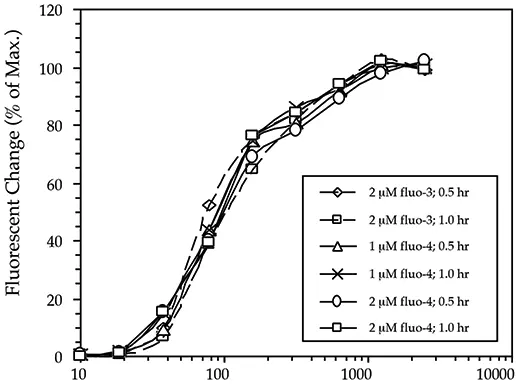
図1: 染料、染料濃度、負荷時間を変えた場合の用量反応曲線(n = 4)。
考察
これらの結果から、fluo-4は標準的に使用されているfluo-3と比較していくつかの利点があることが示された。2 µM fluo-4を使用した場合、fluo-3を使用した場合と同等かそれ以上の負荷で、負荷時間を1.0時間から0.5時間に短縮することができる。
ローディング時間の短縮は、時間の節約になるだけでなく、露光時間の短縮によってカルシウム感受性色素の潜在的な毒性作用が減少する可能性もあるため、有益である。さらに、ローディング時間を短くすることで、細胞質から細胞内コンパートメント(ミトコンドリアなど)に移動する色素の量を減らすことができる。
fluo-4を使用する際に可能なローディング時間の短縮は、刺激されたセルと刺激されていないセルで生じる蛍光の比を増加させることにより、シグナルトノイズ比も改善する。これは、色素の露出が減少することで、細胞生存率が向上するためと考えられる。相対的なバックグラウンド蛍光の減少は、細胞内コンパートメントに蓄積された色素量の減少に起因する可能性もある。
この研究は、HTS や FLIPR システムで頻繁に使用される CHO 細胞株を用いて行われた。しかし、色素は細胞株によって挙動が異なるため、新たに研究する細胞株ごとに適切な色素と負荷条件を試験することが重要である。
PDF版(英語)