遺伝子編集 (CRISPR/Cas9) 遺伝子編集の可能性を広げるCRISPRの自動化ソリューション
遺伝子編集とは
遺伝子編集とは、生物のゲノムDNAを欠失したり、挿入、置換、改変する遺伝子操作のことです。さまざまな技術によってDNAに切断を生じさせる部位特異的な標的であって、必ずしも修復機構が関与するわけではありません。遺伝子編集は、不活性化と修正という2つの技術で構成されています。
不活性化には標的遺伝子の転換が含まれ、修正では遺伝子の切断による欠陥遺伝子の修復が促進されます。遺伝子編集は、医薬品開発や遺伝子手術、動物モデルや病気の調査と治療、さらに食品やバイオ燃料、生体材料合成など、さまざま分野で広く活用されており、今後も活用範囲が増えていくと考えられています。
遺伝子編集が最初に研究されたのは1900年代後半です。その後、CRISPRが遺伝子編集技術の主な手法として広く使われるようになると、遺伝子治療は遺伝子編集の応用として注目されるようになりました。CRISPRは、欠陥のある遺伝子や欠落した遺伝子を補うために既存の遺伝子に付加する遺伝子付加と、病気に関連するDNAを直接改変することによって病気を治療する遺伝子編集という2つのアプローチによって達成することができます。
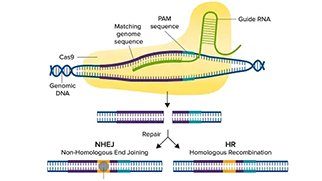
crRNAに似たガイドRNA(gRNA)は遺伝子内のある領域を標的として設計され、Cas9酵素は宿主細胞ゲノムのこの特定領域に二本鎖切断を作り出すことができます(図1)。二本鎖切断が生じると、細胞は非相同末端接合(NHEJ)経路または相同性指向性組換え(HDR)経路という2つの修復経路のいずれかを辿ります。NHEJ経路は、塩基の挿入や欠失(indel)を介して遺伝子を破壊するために使用され、HDR経路は、2つの類似または同一のDNA分子間で配列を交換することにより、レポーター遺伝子や編集された配列をノックインするために使用されます。
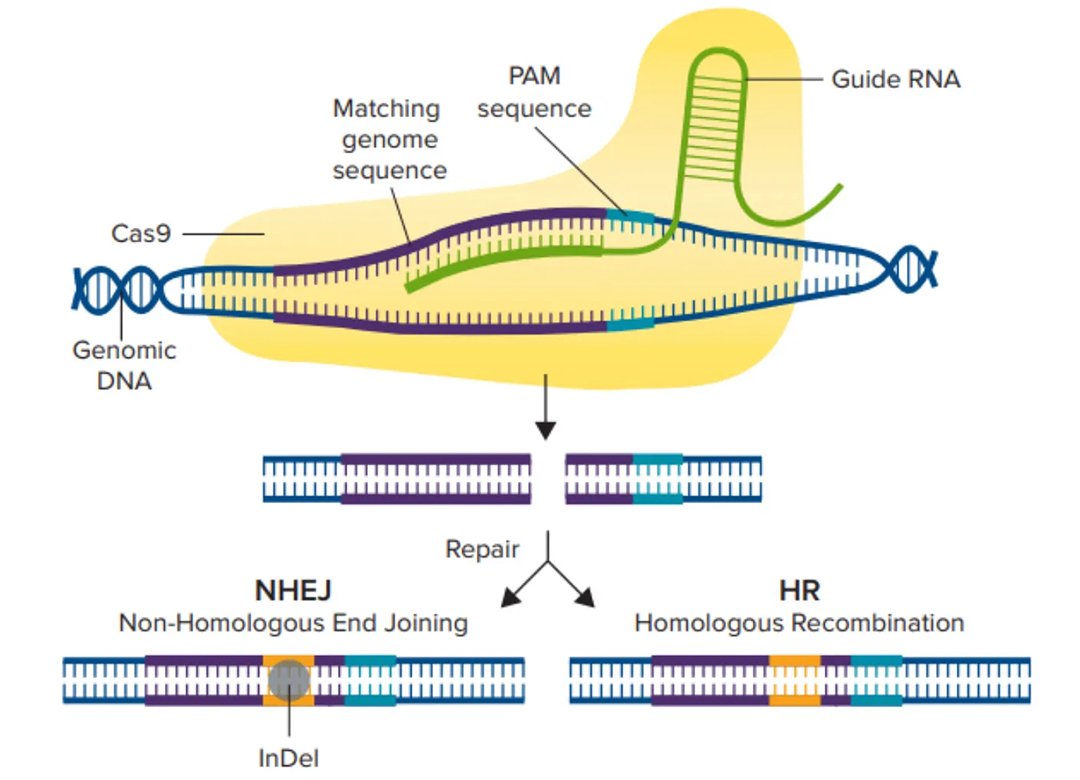
CRISPRによる遺伝子編集のスケールアップ
「CRISPR」はClustered Regularly Interspaced Short Palindromic Repeatsの略です。このDNA配列は、細菌や古細菌などの原核生物の免疫システムの一部として最初に発見され、2012年以降、遺伝子編集ツールとして重要性が高まっています(Jinek et al.)。この遺伝子編集ツールは、その精度の高さから、DNA配列の挿入(ノックイン)、欠失(ノックアウト)などの改変ができ、農業、疾病モデル、遺伝子治療、創薬など、数え切れないほどの応用が期待されています。従来はTALENSやZFNSのような手間がかかる高価な既存の遺伝子編集ツールが主流でしたが、CRISPRの登場で様変わりしました。
CRISPRの配列は、各回文反復の後にスペーサーと呼ばれる過去のウイルス侵入者のDNAを含んでおり、これらは将来の類似ウイルスの検出と破壊に役立ちます。このメカニズムの理解が広がったことで(Jinek et al., 2012)、真核細胞においてCRISPRが最初に使用され(Cong, L, et al., 2013)、後に異なる分野に属する他の細胞タイプおよび生物体でも使用されるようになりました。CRISPR-Cas9システムには、リボ核タンパク質複合体を形成する2つの主要コンポーネントがあります。第一の構成要素またはガイドRNAはゲノム中の相補的DNA配列に結合し、第二の構成要素である化膿連鎖球菌由来のCas9(SpCas9)は標的部位で二本鎖切断を行います。プロトスペーサー隣接モチーフ(PAM)は、上流の切断が起こるためにヌクレアーゼが最初に結合する場所です。異なるCRISPRヌクレアーゼは異なるPAM部位を持っており、カットが行われると細胞の修復システムが活性化され、ゲノムの編集も開始されます。
遺伝子編集ワークフロー
CRISPR機構を用いた遺伝子編集ワークフローでは、編集が確認された細胞株を得るために様々なステップが必要です。適切なツールを用いてこれらの作業を最適化することは、時間や労力、コストの削減につながります。作業の最適化は、研究開発を加速し、創薬、病気治療、遺伝子編集作物生産などに革命をもたらします。遺伝子編集を通じて世界中の科学コミュニティが目指す目標を達成するための手順と、効果的な解決策についてご紹介します。
遺伝子編集 (CRISPR/Cas9)を支援する製品・サービス
-
DispenCell
シングルセルディスペンサー
効率的で信頼性の高いシングルセルの単離を可能にします
-
QPix
微生物コロニーピッカー
最大3000コロニー/時間のピッキングが可能な自動微生物スクリーニングシステム
-
CloneSelect Imager
(CSI and CSI FL)
蛍光および明視野での高速な画像取得とモノクローナリティレポートの作成機能を含む
インテリジェントな画像解析を実装するシステム -
ClonePix 2
自動動物細胞コロニーピッキングシステム
モノクローナル抗体やバイオ医薬品を生産する細胞株樹立ワークフローの自動化ソリューション
-
細胞イメージング
システム
自動デジタル顕微鏡から最新の機械学習解析ソフトウェアを備えたハイスループット共焦点イメージングシステムまで、ハイコンテントイメージングと解析ソリューション
-
マイクロプレートリーダー
ソリューション
高感度で堅牢なマイクロプレートリーダーと直感的で使いやすいデータ取得・解析ソフトウェアソリューションで生産性を向上
CRISPR/Cas9遺伝子編集を検証するための研究ソリューション
モレキュラーデバイスの各種装置は、遺伝子編集の試みを成功させるための実験の実施/スクリーニングに最適です。新たに発売されたCloneSelect Imager Florescence (CSI-FL)は、単一細胞プリンティング後のモノクローナリティDay0保証、トランスフェクション効率、細胞コンフルエント、およびマルチチャンネル蛍光スクリーニングデータを提供し、より短い追跡時間、過剰継代の低リスク、およびロボット操作によって遺伝子編集の有効性を検証します。
さらに、SpectraMax i3xマルチモードマイクロプレートリーダーは、トランスフェクション効率の評価、細胞増殖のモニター、DNAおよびタンパク質の定量、ScanLaterウェスタンブロット解析によるCRISPR/Cas9編集の検証に使用できます。さらにImageXpress Micro Confocal Systemを使用することで、オートファゴソームの高画質画像を取得することができます。MetaXpress HCIソフトウェアはすべての細胞から個々のオートファゴソームを同定・定量することができるため、CRISPR/Cas9遺伝子編集から生じる表現型の変化を解析することが可能です。
-
遺伝子編集細胞株の加速
新しいCloneSelect® Imager FLは、トランスフェクションに成功した細胞を検出し、細胞株開発にかかる時間を短縮します。CloneSelect® Imager FLは、トランスフェクション効率の低いプールを早い段階で排除し、マルチチャンネル蛍光検出でさまざまなCRISPR編集を確認、追跡し、正確で信頼性の高い細胞スクリーニングを行います。
CloneSelect Imager FLによる遺伝子編集セルラインの高速化 > -
細胞株開発におけるCRISPR
CRISPRによる標的遺伝子編集は主に細胞株開発や細胞治療、遺伝子治療など、さまざまな分野で応用されています。 細胞株開発では、生物産物を産生する安定細胞を見つけるために、クローンをスクリーニングする必要があります。このアプリケーションノートでは、哺乳類細胞株開発ワークフローの自動化、つまり編集、単クローン性、増殖評価に関するトランスフェクト細胞の自動化された統合スクリーニングについて説明します。
CRISPRベースの細胞株開発ワークフローの自動化 > -
CRISPR/Cas9ゲノム編集実験
CRISPR/Cas9遺伝子編集システムは、その比較的簡単な操作性と正確性から、遺伝子機能研究では非常にポピュラーなツールになっています。遺伝性疾患の治療へ大きな可能性を秘めているシステムでもあります。CRISPR/Cas9遺伝子編集のバリデーションは、目的の遺伝子が正常にノックダウンまたはノックアウトされていることを確認するのに役立ちます。ここでは、CRISPR/Cas9を用いてHEK293細胞でオートファジー関連タンパク質5(ATG5)をノックダウンすることにより、モレキュラーデバイスの各種装置が遺伝子編集実験にどのように活用できるかを説明します。
CRISPR/Cas9遺伝子編集システム > -
クローン生産性
スクリーニングと力価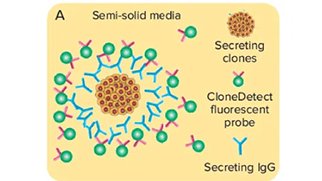
価値の高いクローンを同定する際には、単一細胞由来のコロニーの生産性を測定しなければいけません。従来の限界希釈から単一細胞を単離し、次いでELISAを用いて力価を評価するという手法では、生産性のスクリーニングに手間と時間がかかりました。しかしClonePix 2システムなら、表現型選択や単細胞分離、生産性スクリーニングを1つのステップにまとめ、スクリーニング時間を劇的に短縮します。
安定高産生なクローンの迅速なスクリーニングと選択 >
CHOセルにおけるIgG生産の自動最適化 >
ウイルス特異性ハイブリドーマの開発促進 > -
カルセインAMによるクローナリティの確実な保証
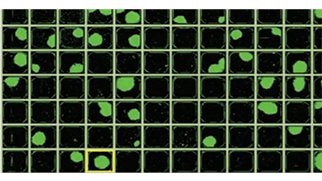
生存率への影響を最小限に抑えながら、カルセインAMを用いてクローナリティを確実に保証します。 ここでは、蛍光試薬であるカルセイン AM と蛍光対応 CloneSelect™ Imager を組み合わせた最適なワークフローを紹介します。このワークフローでは、ラベルフリーの条件と同様の生存率を示すと同時に、クローナリティの高い保証が得られます。
ポスター:カルセイン-AM生存率色素を用いたモノクローナル性保証のための蛍光アプローチの評価 > -
創薬と医薬品開発

新しく作られる医薬品のうち9割は成功しません。この原因の一つに、複雑なヒトの生物学を忠実に模倣していない2次元細胞培養に依存していることがあります。このことが多くのケースで薬剤の可能性の不正確な予測や薬剤開発期間の延長を招いています。
創薬・医薬品開発を見る > -
単クローン性
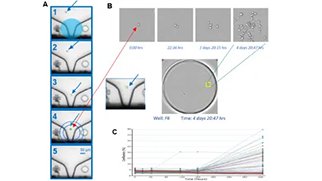
細胞株の樹立と単クローン性の保証は、モノクローナル抗体のようなバイオ医薬品分子を生成するプロセスにおいて重要なステップです。細胞株は、目的のタンパク質を強固に発現する単一の生存細胞を単離した後に樹立することができます。このプロセスにおける重要なマイルストーンは、クローナリティの証拠を文書化することです。クローナリティの証明は通常画像ベースで行われます。そこで作成された単一細胞の画像を規制当局へ提出します。
単クローン性を見る > -
プラスミド生産

プラスミドは、染色体DNAとは独立して機能する小さな環状DNA分子です。分子生物学の中心的存在であり、遺伝子の研究や操作、生産を可能にし、クローニングや遺伝子治療、ワクチン開発において重要な役割を果たしています。
プラスミド生産を見る > -
単一細胞の選別

細胞株の開発には、標的治療タンパク質の生産率の高い単一細胞由来のクローンを見つける必要があります。そのためには生存可能な単一細胞を単離する必要があります。限界希釈は統計的確率に基づく技術ですが、時間がかかります。DispenCell™ Single-Cell Dispenserは、迅速、かつ穏やかな細胞の単離を可能にし、細胞分注後のクローナリティとトレーサビリティを証明します。
DispenCell™ シングルディスペンサーを見る > -
トランスフェクション効率
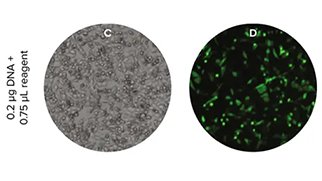
蛍光レポーター遺伝子のトランスフェクション効率は、様々な方法でモニタリングできます。そのうちの一つが、マイクロプレートリーダーで蛍光を測定する方法です。しかし各試験ウェルの全体的な蛍光レベ ルを評価できるものの、トランスフェクションされた細胞の割合まではわかりません。トランスフェクション効率を評価するためには、検出可能な蛍光を発現している細胞数を全細胞数と比較できるイメージングサイトメーターを用いた細胞分析が必要です。イメージングサイトメーターには、トランスフェクション前の細胞コンフルエンスを計算できるという利点もあり、この情報をアッセイ開発の一部として利用することができます。
SpectraMax i3マルチモード検出プラットフォームによる > -
ウェスタンブロットを用いたCRISPR編集細胞の検証
CRISPR遺伝子編集技術では、正確な結果を得るためにプロセス全体を注意深くモニタリングする必要があります。SpectraMax i3x マルチモードマイクロプレートリーダーは、最初のトランスフェクションからタンパク質ノックダウンの確認まで、CRISPR編集実験の結果を分析するための一貫したソリューションを提供します。MiniMaxサイトメーターを使用すると、研究者は非標識細胞の総数と蛍光を発現するトランスフェクト細胞の数を比較することにより、トランスフェクション効率を評価することができます。また、ScanLaterウェスタンブロット検出システムは、コントロール細胞とCRISPR編集細胞における目的のタンパク質の高感度検出と定量分析が可能です。
マイクロプレート上でのイメージングとウェスタンブロット検出を用いたCRISPR編集細胞の検証 >