Application Note マルチパラメトリックTHP-1細胞ベースアッセイを用いた抗炎症化合物の評価
- サンプル量に制限のある複数分析物の測定
- 試薬使用量を5~10倍削減し、3時間以内に結果を提供
- 自動イメージングでマクロファージの分化を観察
PDF版(英語)
はじめに
オクサナ・シレンコ博士|シニアリサーチサイエンティスト|モレキュラーデバイス社
キャシー・オルセン博士|Sr.アプリケーションサイエンティスト|モレキュラー・デバイス
エヴァン・クロムウェル博士|CEO|プロテイン・フルイディクス
マクロファージは血液中の単球を起源とし、循環を離れて様々な組織に侵入し、そこでマクロファージに分化する。マクロファージは病原体の除去と死細胞の貪食に関与する。さらに、血管細胞を活性化し、マクロファージの血管への接着と組織への遊走を促進するサイトカインを放出することにより、炎症を引き起こす。分化THP-1セルは、炎症反応におけるマクロファージの関与に関する研究において、マクロファージのin vitroモデルとして広く用いられてきた。活性化されたTHP-1細胞は形態を変え、より接着するようになる。また、LPSによって開始される細胞シグナリングイベントのカスケードの結果として、炎症性サイトカインを分泌する。サイトカインの発現レベルは、細胞ベースの炎症モデルにとって重要な生理学的指標である。
我々は、マルチパラメトリックなTHP-1細胞ベースアッセイの結果を発表する。細胞形態と接着を評価するために、ImageXpress® Pico自動細胞イメージングシステムを用いた表現型イメージングを用いた。また、Pu-MAシステムで実行し、SpectraMax® iD5 マルチモードマイクロプレートリーダーで検出する低容量の酵素結合免疫吸着アッセイ(ELISA)を使用して、分泌サイトカインを測定し、炎症反応に対する化合物の効果を評価しました。マルチパラメトリックアッセイのワークフローを図1に示す。
PMAおよびLPSで刺激したTHP-1細胞では、IL-8、IL-1ßおよびTNF-α分泌の増加が観察された。抗炎症性化合物の効果を評価するため、セルをp38 MAPキナーゼ(MAPK)阻害剤SB202190とピロリジンジチオカルバメート(PDTC)、抗生物質モキシフロキサシンで追加処理した。SB202190はJAK/STATおよびNFκB経路に作用する2。抗酸化剤のPDTCはNFκBの活性化を抑制する3。モキシフロキサシンは、NF-κB、ERK、JNKの活性化を阻害することにより、IL-8とTNFαを抑制する4。化合物による炎症反応の阻害は、細胞接着の変化、サイトカインとケモカインの分泌の変化を定量することによって測定された。選択した化合物について、濃度依存的な発現低下が見られた。細胞の形態と接着に対する影響は、細胞イメージの表現型解析によっても評価した。
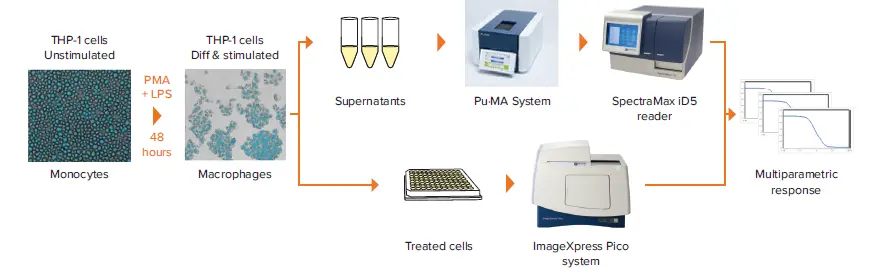
図1. マルチパラメトリックアッセイのワークフロー。ImageXpress Picoシステム、Pu-MAシステム、およびSpectraMax iD5リーダーを使用して、マクロファージ形成を表現型解析し、分泌サイトカインレベルを定量して、炎症反応に対する薬理学的化合物の効果を評価した。
材料
- THP-1細胞(ATCC)
- PMA(シグマ)
- LPS(シグマ)
- SB202190(シグマ)
- PDTC(シグマ)
- モキシフロキサシン(シグマ)
- IL-8、IL-1ß、TNFα用ELISA抗体ペア(BioLegend社製)
- ImageXpress Pico自動細胞イメージングシステム(Molecular Devices社製)
- Pu-MAシステム(Protein Fluidics社製)
- SpectraMax iD5マルチモードマイクロプレートリーダー(Molecular Devices)
方法
- THP-1細胞を96ウェルマイクロプレートの1ウェルあたり20,000個プレーティングし、48時間インキュベートした。その後、PMAとLPSの混合液(PMAは0~5 pg/mL、LPSは0~100 pg/mL)で24時間刺激した。
- 抗炎症化合物は刺激の2時間前に添加した。
- インキュベーション後、ELISA用に各ウェルから60μLの上清を採取した。サンプルは新鮮なまま分析するか、-70℃で保存し、その後の分析に備えた。
- 上清をアッセイバッファーで3:1に希釈し、Pu-MAシステムフローチップと試薬を用いてIL-8、TNFα、IL-1ßを分析した。 結果はSpectraMax iD5リーダーの吸光度モードで検出した。
- セルはImageXpress Picoシステムを用いて透過光(TL)でイメージングした。接着していない細胞は、培地で2回洗浄して除去した。TL画像中のセルは、CellReporterXpress ™ 画像取得・解析ソフトウェアを用いてカウントした。
結果
PMAとLPSで刺激すると、活性化THP-1細胞はプレーティング表面に接着し、サイトカインを発現した。 細胞をImageXpress Picoシステムで透過光イメージングし、刺激前後の細胞形態を比較した。
THP-1刺激による表現型の変化を図2に示す。セル形態は、単球で一般的に観察される、小さく、真円性で、非接着性の表現型から、大きく、平坦で、より接着性の高いマクロファージ表現型へと変化した。非接着細胞を洗い流した後に存在する接着細胞の数を、ImageXpress PicoシステムとCellReporterXpressソフトウェアを用いて定量した。

図2.非刺激(左)または刺激(右)THP-1細胞の非付着細胞除去前(上)と除去後(下)の透過光イメージ。CellReporterXpressソフトウエアで細胞数をカウントするための解析マスクは白抜きで示した(下)。
ケモカインIL-8と、細胞刺激に反応して分泌されるサイトカインIL-1ßとTNF-αの上清中の濃度は、自動化された低容量のPu-MAシステムを用いて測定した。少量のサンプル量(10-20μL)と既存の抗体ペアを使用します。これにより、サンプル量に制限がある場合でも、複数の分析物を測定することができる。 細胞刺激によるケモカインおよびサイトカイン分泌の増加を図3に示す。刺激した細胞では、未刺激の細胞と比較してIL-8が30倍、IL-1βが6倍、TNFαが15倍増加した。
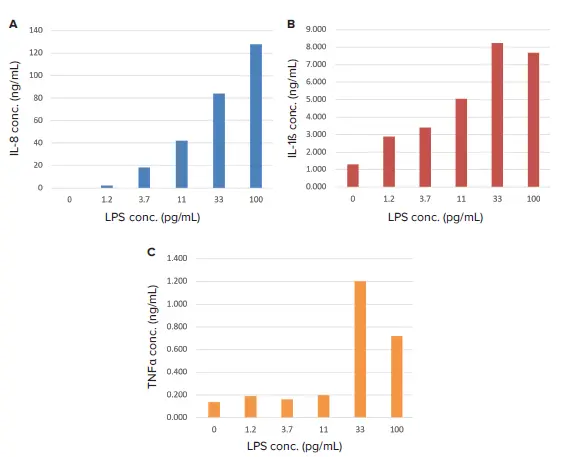
図3. LPSに対するケモカインとサイトカインの分泌。IL-8(A)、IL-1β(B)、TNFα(C)の濃度はLPSに反応して上昇した。
刺激THP-1細胞の細胞形態、接着、IL-8の分泌に対するいくつかの抗炎症性化合物の効果を調べた。抗炎症化合物による細胞形態の変化をImageXpress Picoシステムを用いてイメージングした(図4)。抗炎症性化合物に対する細胞接着の変化を測定するため、洗浄の前後に存在する接着細胞の数を画像解析により決定した。画像中の細胞をCellReporterXpressソフトウェアでカウントし、データをSoftMax Proソフトウェアにインポートして、4パラメータカーブフィットを用いてEC50値を算出した。これらの細胞の上清を、Pu-MAシステムとSpectraMax iD5リーダーを用いてアッセイし、ケモカインIL-8の分泌に対する抗炎症化合物の効果を測定した。SB202190、PDTCおよびモキシフロキサシンで処理すると、濃度依存的にIL-8の分泌が減少し、接着細胞数が減少した(図5)。 4パラメータカーブフィットを用いて決定したEC50値を表1に示す。
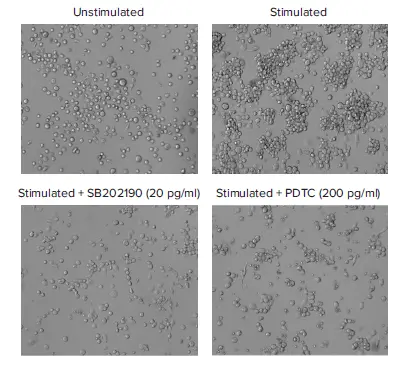
図4.THP-1細胞の表現型反応に対する抗炎症化合物の効果。上:PMA+LPS刺激の有無によるTHP-1細胞の透過光イメージング。下:PMA + LPS刺激前に抗炎症性化合物とインキュベートした刺激細胞。
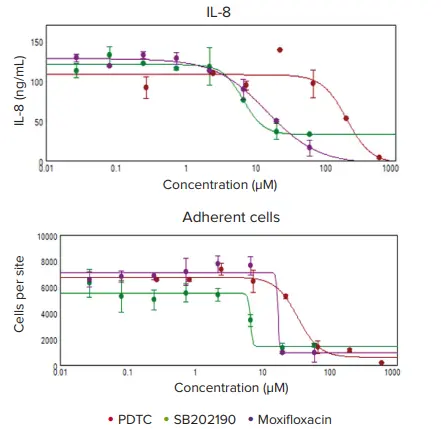
図5. IL-8レベルと接着細胞数に対する抗炎症化合物の効果。
|
EC 50 μM |
aIL-8 | IL | TNFα | Adhesion |
|---|---|---|---|---|
| PDTC | 201 | 42 | 63 | 33 |
| 2B202190 | 6.6 | 9.8 | 6.4 | 6.6 |
| モキシフロキサシン | 17.4 | 9.9 | 17.9 |
17.1 |
表1. SoftMax® Proソフトウェアを用いた4パラメータフィットから得られたEC50値。
結論
THP-1 細胞モデルとImageXpress Pic-自動細胞イメージングシステム-Pu-MAシステム-新規の少量自動ELISAシステム-SpectraMax iD5マイクロプレートリーダーを用いたマルチパラメトリック炎症アッセイを紹介する。処理した細胞をImageXpress Picoシステムでイメージングし、CellReporterXpressソフトウェアを用いて刺激に反応して接着した細胞をカウントした。Pu-MAシステムは、試薬使用量を5-10倍削減し、結果を3時間未満で提供するマイクロ流体フローチップを用いて、既存のELISA抗体ペアでイムノアッセイを実施するために使用された。ELISA結果はSpectraMax iD5リーダーで検出され、結果はSoftMax Proソフトウェアで解析された。このワークフローを用いて、3種類の抗炎症性化合物に対するケモカインとサイトカイン(IL-8、IL-1ß、TNFα)の分泌の変化をモニターした。観察されたケモカインとサイトカインレベルの違いは、発表されている作用機序と一致していた。
参考文献
- 最適化されたTHP-1の分化には...; Parkら, Inflamm Res. 2007, 56, 45.
- p38αMAPキナーゼは、細胞型特異的に炎症機能を発揮する...; Kim et al, Nat Immunol 2008, 9, 1019.
- PDTCは強力な抗酸化物質である...; Zhu et al, FEBS Letters 2002, 532, 80.
- モキシフロキサシンの抗炎症作用...; Weiss et al, Antimicrob Agents Chemother 2004, 48, 1974.
PDF版(英語)