Application Note がんスフェロイド培養における
化合物効果の3D解析および形態学的特性評価
- スフェロイドのハイスループットスクリーニングを実施し、効率的かつ一貫性のある取得を実現します。
- より生理学的に関連性の高いモデルの特性を定量化および測定
- 統合ソフトウェアソリューションによる解析時間の短縮
PDF版(英語)
はじめに
半固形培地(軟寒天培地やマトリゲル培地)での細胞培養を用いた細胞形質転換/腫瘍原性アッセイは、がん研究においてよく確立されている1,2,5。このアッセイでは、がん細胞の特徴である接着に依存しない方法で細胞が増殖する必要がある。2D細胞単層で増殖させた接着細胞に比べて、3D増殖条件はがん細胞の自然環境をより正確に反映すると考えられており、2D培養と動物実験のギャップを埋めるものである3,5。重要なことに、3Dアッセイは、マウス異種移植片などの動物における腫瘍形成性とより高い相関性を示した5。個々の患者から採取した腫瘍セルを用いて、薬剤パネル4に対する感受性を調べる個別化医療のための手法開発への関心が高まっていることから、より適切で時間的制約のない研究が必要とされている。
3Dアッセイは、以前は手間がかかり、コロニーの定義が主観的なため一貫性がなく、ハイスループットスクリーニングには適していませんでした。本研究では、ハイコンテントイメージャーと3D解析を用いて、半固形培地中の細胞増殖に対する化合物の影響を測定・定量化する、ハイスループット・スクリーニングに適合した方法を説明する。
スクリーニングに適した実験プロトコール
半固形培地でのスフェロイド培養を調製するため、ヒト結腸癌 HCT116細胞を、成長培地で希釈した4.25mg/mLコールドマトリゲル(コーニング社製)溶液とあらかじめ混合し、96ウェル半球プレート(グレイナー社製)に、総容量25μL、細胞数500個/ウェルの密度でプレーティングした。プレートを37℃で30分間インキュベートしてゲルを固化させ、その後25μLの培地を加えた。24-48時間以内に、各ウェルにスフェロイド・コロニーが形成された。
得られたスフェロイド培養物を抗がん化合物で5日間処理した。化合物を培地で2倍濃度に希釈し、6点希釈系列25μLをトリプリケートウェルに添加した。3日目には、培地の半分を1倍濃度の化合物希釈液と交換して、新鮮な化合物を加えた。試験化合物による処理の最後に、細胞を2種類の色素の混合物で染色した:最終濃度1μM calcein AMと5μM Hoechst 33342(Life Technologies)。色素溶液は3倍濃度に調製し、吸引せずに培地に直接添加し、イメージング前に2時間インキュベートした。別のアッセイ法では、細胞を4%ホルムアルデヒド溶液で1時間固定し、PBSで3回洗浄した。その後、細胞を5μM Hoechst 33342と0.06μM AlexaFluor-488 Phalloidin(Life Technologies)で染色した。
統合共焦点イメージングと3D解析
画像は、ImageXpress® Micro Confocalハイコンテントイメージングシステムを用い、20× Plan Fluorまたは10× Plan Fluor対物レンズで取得した(図1)。100~150μmのz-スタック範囲を、5~10μm(10倍率)または2~5μm(20倍率)で区切られた11~20枚のz-スライスで取得した。ウェルあたり2部位を取得し、各Z-stackの2D最大プロジェクション画像と同様に、すべての個々のZ-スライスを3D解析用に保存した(図2)。
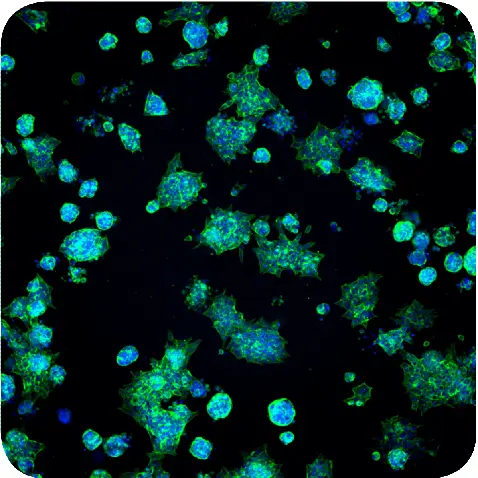
図1. HoechstとAF488-phalloidinで染色したマトリゲル中のスフェロイドの最大投影画像。
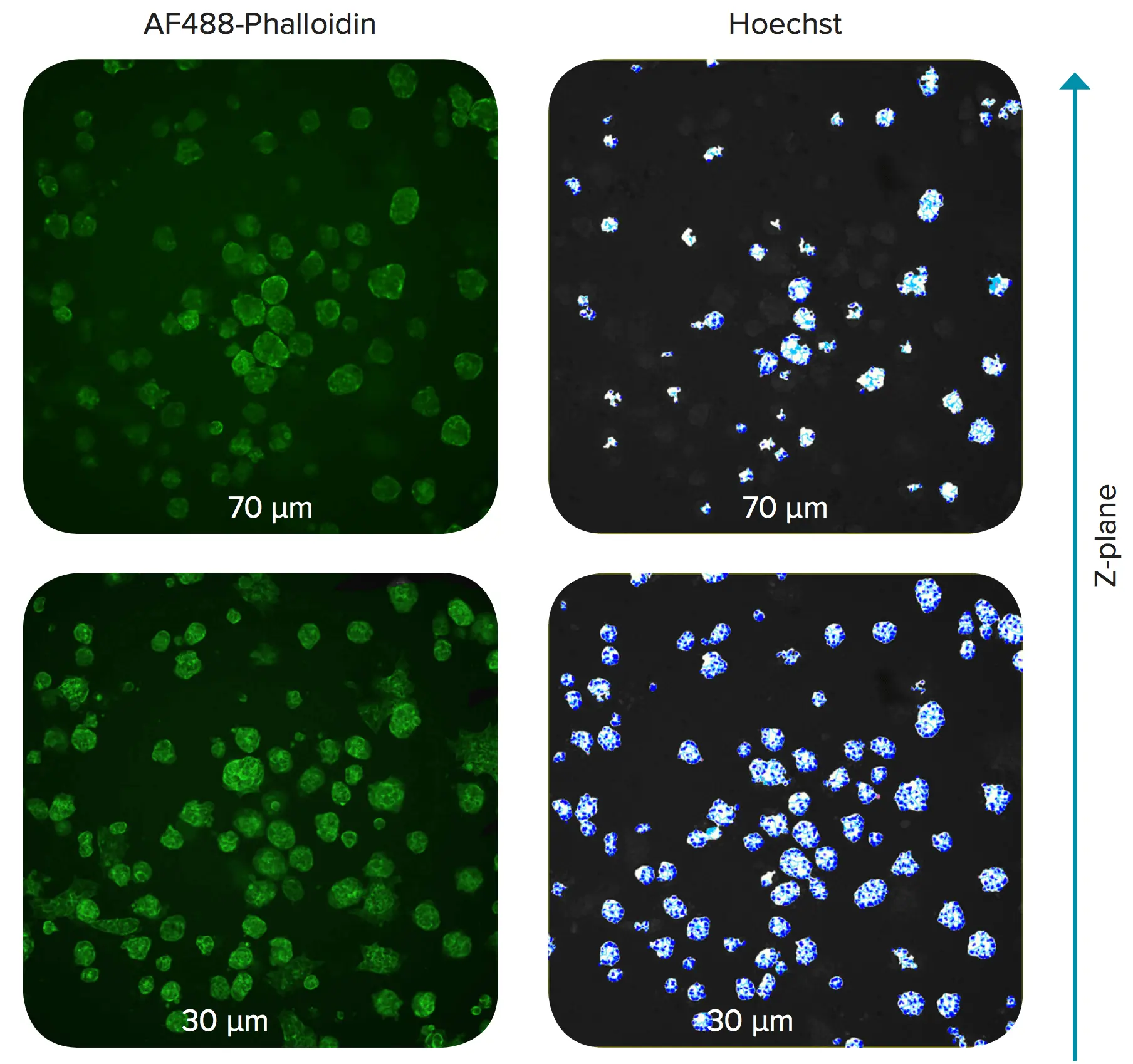
図2. マトリゲル中のスフェロイドのZ平面。スフェロイドはHoechstとAF488-ファロイジンで染色した。ウェルの底からの距離を示す。
画像はMetaXpress® ハイコンテント画像取得・解析ソフトウェアのカスタムモジュールエディター内の3D解析モジュールを用いて解析した。スフェロイドと個々のセルは、サイズと強度に基づいて定義された。次に、スフェロイドのサイズと表現型を、体積、直径、細胞マーカーの蛍光強度によって特徴付けた。マルチパラメトリック出力は、カスタマイズされた解析モジュールを用いて生成され(図3)、個々のスフェロイドの読み出し値には、核数、サイズ、体積、強度、スフェロイドあたりの生細胞、全細胞の体積と直径、スフェロイドの直径、細胞マーカー(カルセインAM、ファロイジン、またはヘキスト)の平均強度などの測定値が含まれた。上記の読み出し値は、個々の対物レンズ(スフェロイド)ごと、またはウェルごとに平均して報告することができる。スコア化されたセル数を増やすために、ウェルあたり追加部位を取得することもできる。IC50値は4パラメータカーブフィットを用いて決定した(図4)。
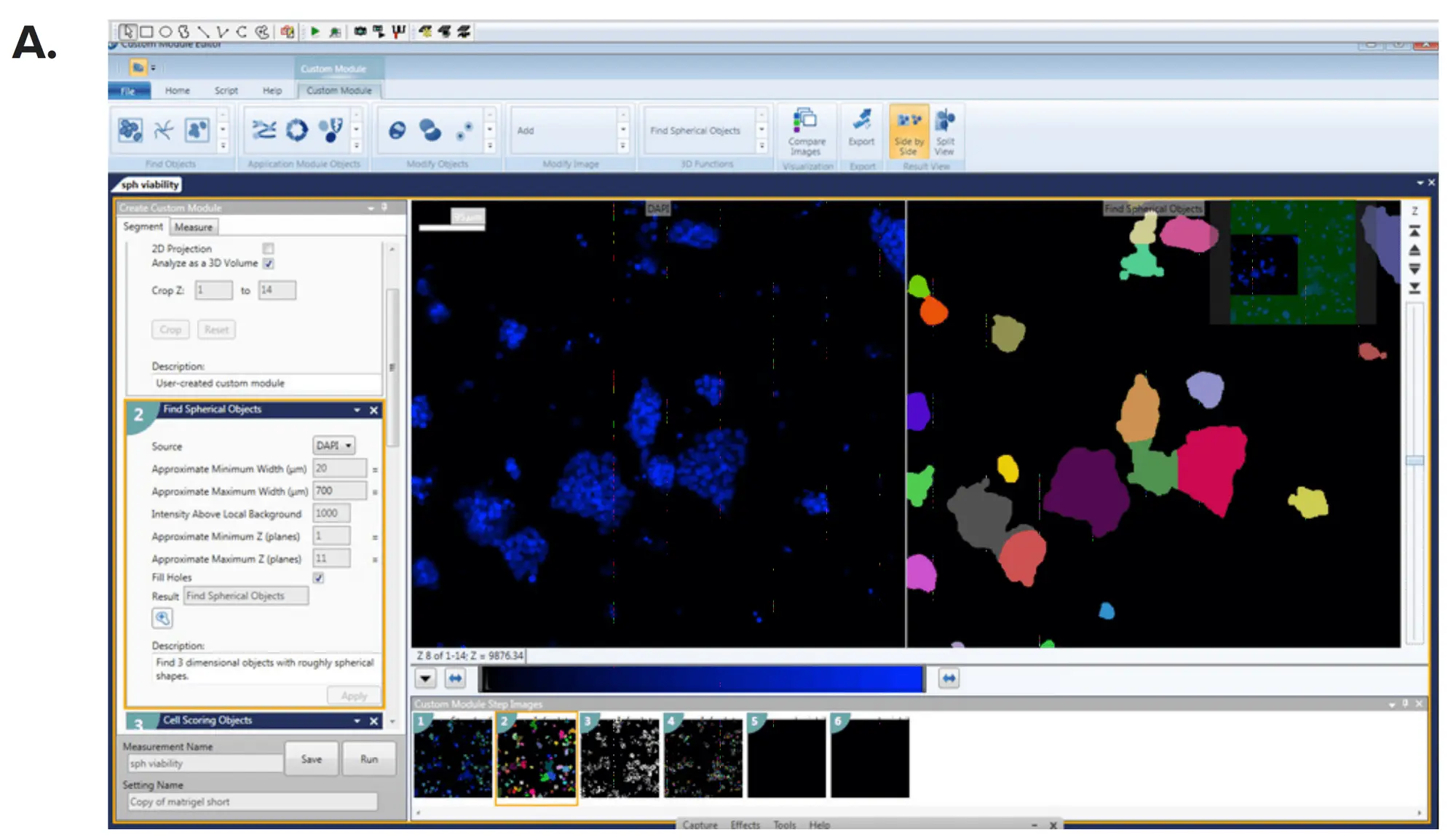
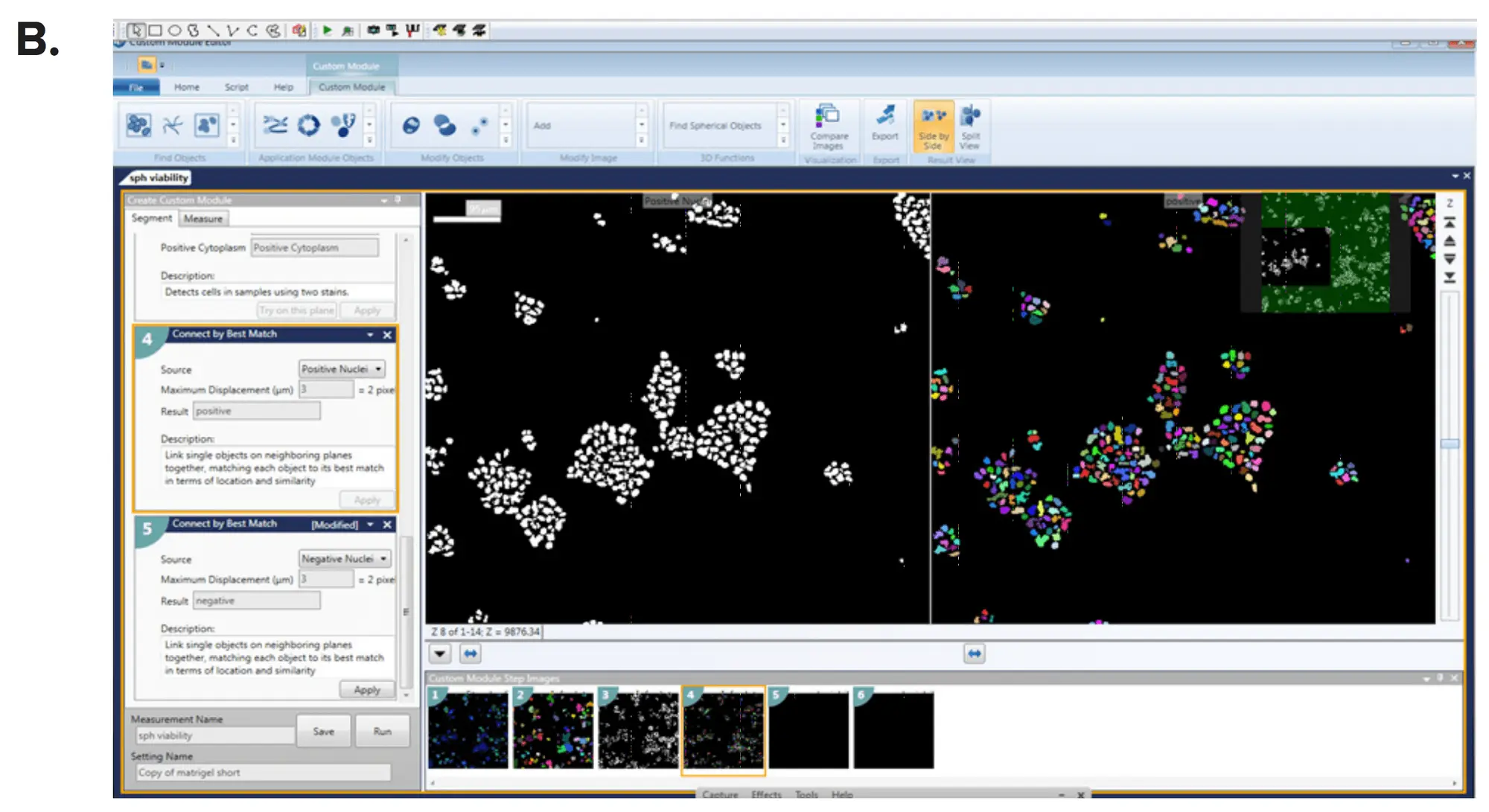
図3.MetaXpress カスタムモジュールエディターを用いたスフェロイドの定義。(A)*
Count Nucleiモジュールと(B) Cell Scoringモジュールは、スフェロイドの数を定義し、個々の細胞は関心のあるマーカーごとにスコアリングされた。
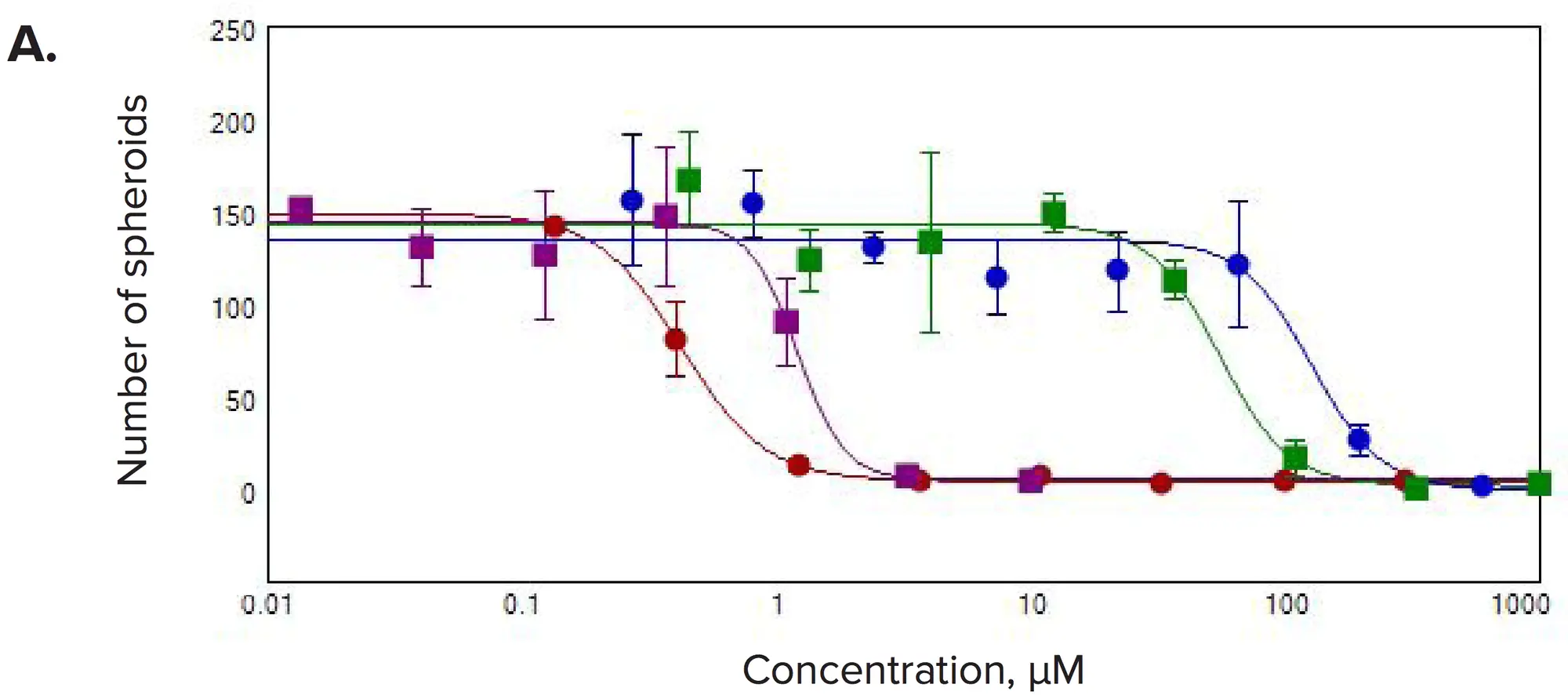
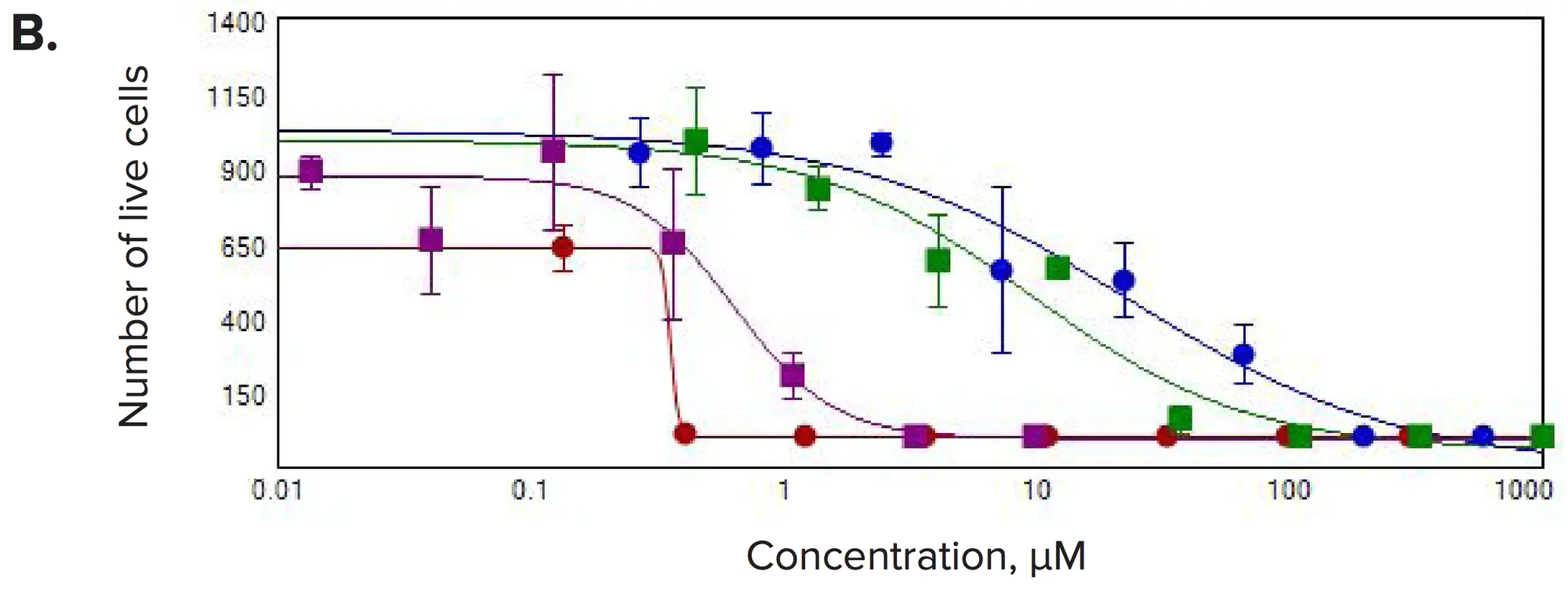
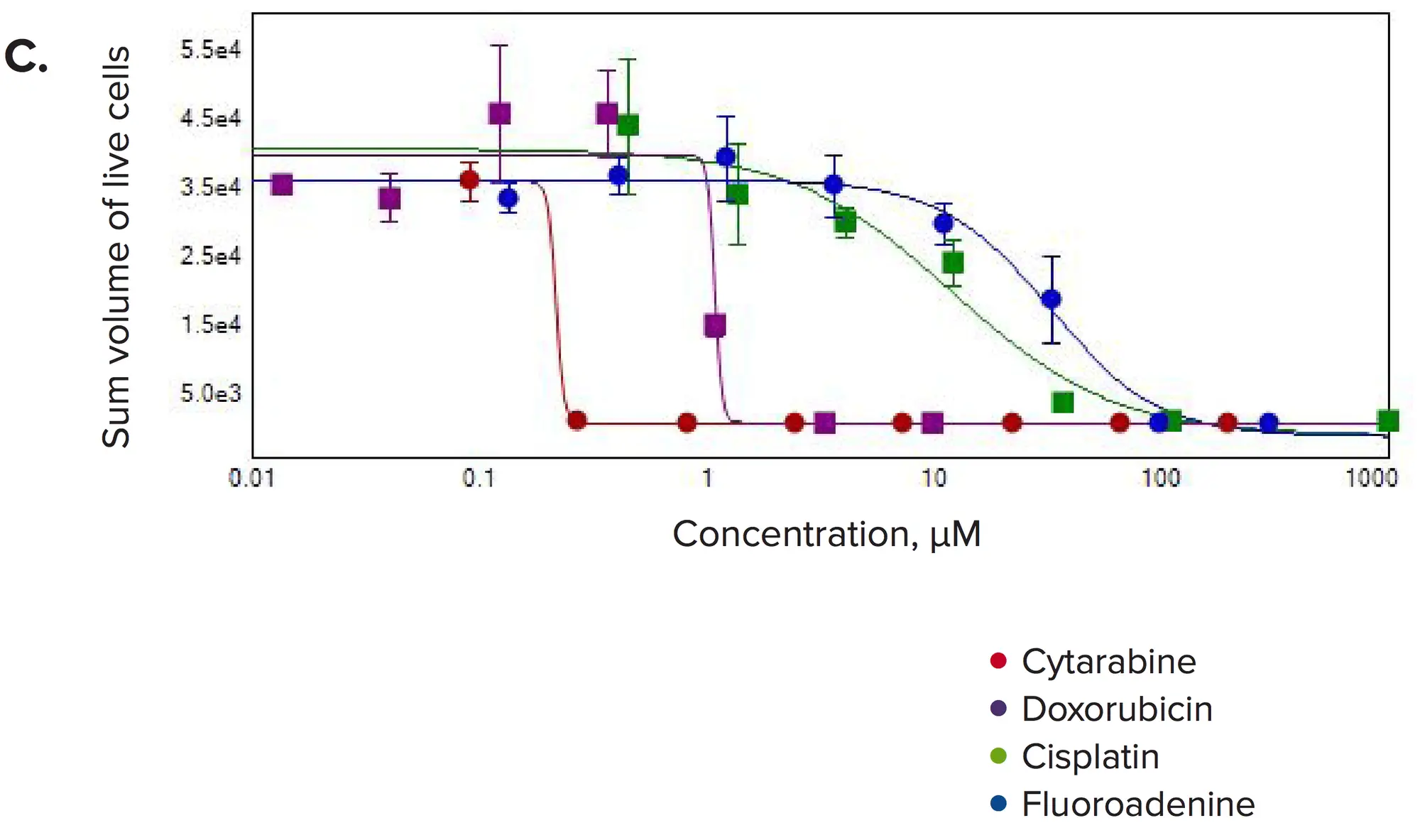
図4. 選択した化合物の濃度反応。(A)スフェロイド数/ウェル、(B)生細胞数/ウェル、(C)生細胞/スフェロイドの体積の合計を3Dボリューム内で測定した。
複数の3Dパラメータが化合物処理の形態学的効果を示す
化合物処理後、有意な変化が観察された。一般的に、スフェロイドの数とスフェロイドあたりの細胞数の減少が見られ、これは予想される抗増殖効果と一致していた。また、各スフェロイド内の生細胞の体積の合計、スフェロイドのサイズ、生細胞数の濃度依存的な減少も観察された。カルセインAMやファロイジン染色の強度は、スフェロイドや個々のセルで劇的に減少した。3D容積内のスフェロイド数の測定は、抗がん化合物に対する反応を示すIC50値の算出に用いられた(表1)。
| 化合物 |
IC >50 μM |
|---|---|
| パクリタキセル | 0.036 +/- 0.021 |
| シタラビン | 0.43 +/- 0.011 |
| スタウロスポリン | 0.169 +/- 0.017 |
| マイトマイシン | 0.177 +/- 0.102 |
| ドキソルビシン | 1.22 +/- 0.411 |
| エトポシド | 2.13 +/- 0.42 |
| シスプラチン | 56.1 +/- 14.1 |
| フルオロアデニン | 129 +/- 41.2 |
表1. ウェルあたりのスフェロイド数を読み取り値として、選択した化合物について測定したIC50値。
要約
3Dスフェロイド細胞モデルとハイコンテント3Dアッセイを組み合わせることで、化合物の効果、増殖、がん細胞の生存率を評価するスクリーニングツールとして有望である。アッセイは、薬剤開発、薬剤の再利用、個別化医療に用いることができる。
リソース
- Grenman, R., Burk, D., Virolainen, E., Buick, R.N.; Church, J.; Schwartz, D.R.; and Carey, T.E. (1989). 限界希釈法を用いたアンカレッジ依存性扁平上皮癌細胞株のクローン形成細胞アッセイ。International Journal of Cancer, 44(1), 131-136.
- MacPherson, I., & Montagnier, L. (1964). ポリオーマウイルスで形質転換された細胞の選択的アッセイのための寒天懸濁培養。Virology, 23, 291-294. Pubmedから入手。
- Pampaloni, F., Reynaud, E. G., & Stelzer, E. H. (2007). 第3の次元は、細胞培養と生きた組織とのギャップを埋める。Nature Reviews Molecular Cell Biology, 8(10), 839-845. Pubmedから取得。
- Rotem, A., Janzer, A., Izar, B., Ji, Z., Doench, J. G., Garraway, L. A., & Struhl, K. (2015). 細胞形質転換のためのハイスループットな薬剤および遺伝子スクリーニングを可能にするソフトアガーアッセイの代替法。Proceedings of the National Academy of Sciences, 112(18), 5708-5713.
- Shin, SI., Freedman, VH., Risser, R., & Pollack, R. (1975). ヌードマウスにおけるウイルス形質転換細胞の形質転換は、in vitroにおける定着非依存性増殖と特異的に相関する。米国科学アカデミー紀要, 72(11), 4435-4439. Pubmedから取得。
ImageXpress®マイクロコンフォーカルハイコンテントイメージングシステムについて詳しくはこちら >>
PDF版(英語)