Application Note 新規フルイディクス・フローチップ技術と
ハイコンテントイメージャーを用いた3D細胞ベースアッセイ
- 3Dスフェロイドおよびオルガノイドアッセイ、化合物試験、疾患モデリングの自動ワークフローを実証する。
- マイクロ流体システムとハイコンテントイメージングシステムを組み合わせ、3D細胞培養、処理、解析を自動化する。
- 細胞の表現型、生存率、分泌因子の分析など、サンプルからさまざまな測定値を得る。
PDF版(英語)
はじめに
オクサナ・シレンコ博士|シニアリサーチサイエンティスト|モレキュラーデバイス
マシュー・ハマー|アプリケーションサイエンティスト|モレキュラー・デバイス
ミシェル・レオン|科学者|プロテイン・フルイディクス
エヴァン・クロムウェル|社長兼CEO|プロテイン・フルイディクス
ラボオンチップシステムとして知られるマイクロ流体工学は、化学的、生物学的、物理的プロセスを制御するために、少量の流体を操作することに成功したことで人気を博した1-3。過去30年にわたるマイクロ流体工学の進歩により、科学者はスループットを最大化し、生産性を向上させると同時に、創薬研究において最高レベルの精度と再現性を確保することができるようになった。
3Dシステムはin vivoでの関連性が高く、創薬スクリーニングキャンペーンの成否を予測するツールとして機能すると考えられている4-8。研究者が依拠する一般的な高度細胞モデルには、スフェロイド、腫瘍細胞、構造化共培養、多細胞オルガノイドなどがある4-6。これらのシステムは、ターゲットIDから前臨床安全性評価まで、医薬品開発パイプラインの多くの分野で見られる。より一般的なのは、腫瘍オルガノイド6のような複雑なモデルを用いた表現型ハイスループットスクリーニングである。これは、生化学的なモデルよりも生理学的な関連性が高いためであるが、取り扱いが難しいだけでなく、画像化も難しい7。
ここでは、ハイコンテントイメージングとマイクロ流体ベースのPu-MAシステム®(Protein Fluidics社製)を組み合わせて、3D細胞モデルを用いた自動アッセイ、イメージング、画像解析を行う方法について説明する。マイクロ流体を使って3D細胞培養と細胞解析を自動化し、培地交換や治療のハンズフリープロセスを可能にすると同時に、ワークフローを簡素化・改善することで、創薬の可能性を前進させる新しい方法を紹介する。
方法
自動フローチップアッセイ
自動フローチップアッセイ
Pu-MAシステム装置は、ポンプ、ユーザーインターフェース、およびプレートチャンバーを封じ込めた中型のボックスで構成されています。装置は標準的な組織培養インキュベーターに簡単に収まる(図1)。

図1. ハイコンテント3D画像と組み合わせた自動オルガノイドアッセイのワークフローのフローチャート。
自動化システムのキーコンポーネントはPu-MAシステムフローチップである(図1)。フローチップは、マイクロ流路で接続された便利なマルチウェルプレートフォーマット(標準384ウェルプレート)のチャンバーとリザーバーで設計されている。各フローチップには、10ウェルが接続された8つのアッセイレーンがあり、4つのフローチップからなるプレートでは32のテストが可能です。マイクロ組織、培地、化合物、その他の試薬は、ウェルにピペッティングすることによりフローチップにプレロードされる。試薬は、384ウェル対応の液体分注システムであればどのようなものでも装置に装填できる。オルガノイドはサンプルウェルの底にある特別に保護されたチャンバーにセットされる。サンプルローディング後、プレートはPu-MAシステムにセットされ、試薬交換はマイクロ流路を通して自動的に行われる。複数の試薬交換が可能なため、複雑なアッセイプロトコールやワークフローを自動的に実行することができます。代表的なアッセイプロトコールプログラムはシステムにあらかじめロードされており、タッチスクリーンインターフェースで選択することができる。プロトコルはユーザーのプロトコールに従って変更することができます。その後、Pu-MAシステムをインキュベーターに設置し、37℃、5% CO2でアッセイを実行します(図1)。
3Dサンプルの処理
本研究のスフェロイド、HCT116細胞(結腸癌細胞株)、HeLa細胞(子宮頸癌細胞株)、HepG2細胞(肝細胞癌細胞株)を、Pu-MAシステムで24-48時間、化合物あり、化合物なしでインキュベートした。いくつかの抗がん化合物(スタウロスポリン、マイトマイシンC、シタラビン、0.1-100μMの範囲、2種類)を、細胞培養培地中の異なる濃度のアリコートとしてあらかじめフローチップに入れ、自動培地交換を用いて3Dマイクロティッシュに添加した。薬剤処理後、分泌因子解析のためにスフェロイド培地を回収した。その後、スフェロイドを適切な色素の分注でフローチップ内で染色した(図の説明を参照)。その後、フローチッププレートを取り出し、ImageXpress® Micro Confocal High-Content Imaging System(Molecular Devices社製)でイメージングした。
in situスフェロイドイメージング
Pu-MAシステムを用いて、がんスフェロイドを染色するための自動オルガノイドアッセイプロトコルを行った(図2に概略図を示す)。図3に示すように、培養したHeLa細胞スフェロイドをPu-MAシステム内のフローチップ内で2時間染色した後、ImageXpress® Micro Confocalシステムを用いてフローチップ内でイメージングした。画像取得は、10X Plan Fluor対物レンズまたは20X Plan Apo Lambda対物レンズを用い、前述のワイドフィールドまたは共焦点取得を用いて行った。10~15μm間隔で7~15枚の画像をスタックし、ウェル底部から開始し、各スフェロイドの下半分をカバーした。Z-スタック画像はスフェロイドの100-200μmをカバーした。合理化された自動染色プロトコールとハイコンテントイメージャーを組み合わせることで、高品質の共焦点データが得られたことを示す。以下の例では、3Dサンプルを用いた複雑な細胞プロトコルの自動化、およびハイコンテントイメージャーとの互換性のためのマイクロ流体システムを示す。
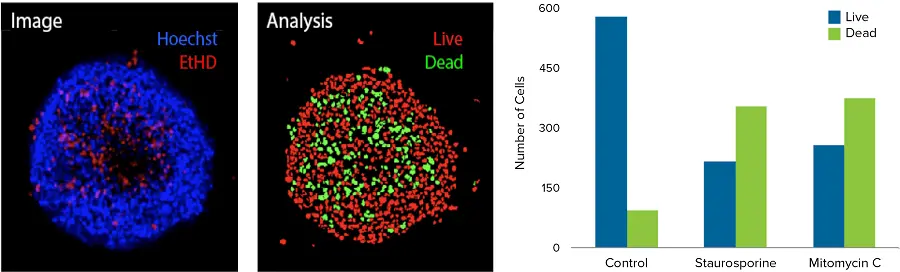
図2. 共焦点イメージングを用いた3Dスフェロイドの画像解析。HCT116 3DスフェロイドをPu-MAシステム中でMethodsのセクションに記載したように抗がん化合物とインキュベートした。その後、3DスフェロイドをEthD-1色素と核染色剤Hoechstで染色し、ImageXpress® Micro Confocalシステムを用いてイメージングした。最大プロジェクション画像と解析マスク。解析マスクは生細胞核(赤色)と死細胞核(緑色)を示す。1μMの標記化合物で処理したスフェロイドの生細胞数と死細胞数を示す棒グラフ。
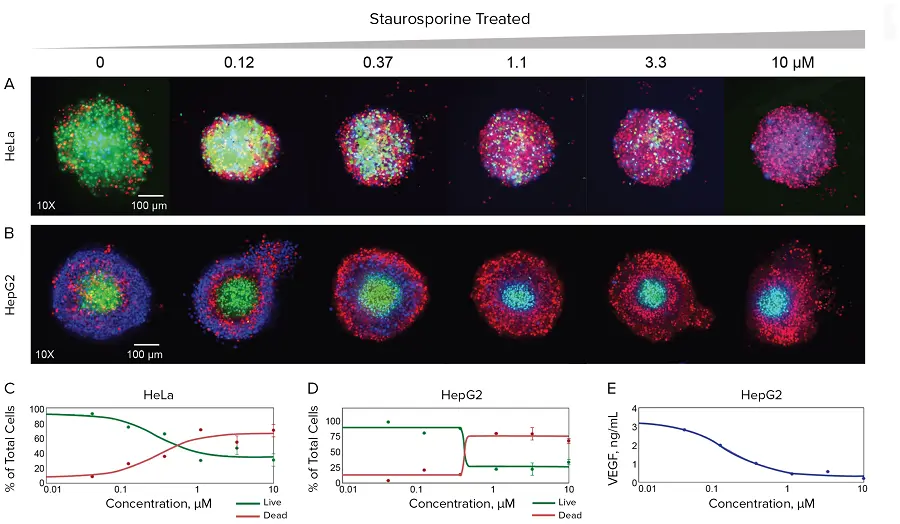
図3. ハイコンテントイメージャーによるスフェロイド形態および生存率に対するスタウロスポリンの効果のイメージングおよび定量評価。HeLaおよびHepG2 3Dスフェロイドを、方法のセクションに記載したように、いくつかの抗がん化合物とともにPu-MAシステムでインキュベートした。3Dスフェロイドを複数の色素の組み合わせで染色し、ImageXpress® Micro Confocalシステムを用いてイメージングした。コントロールのスフェロイドと指示された濃度のスタウロスポリンで処理したスフェロイドの最大プロジェクション画像を示す。HeLa細胞はHoechst核色素(青)、Calcein AM生存率色素(緑)、EthD-1死細胞色素(赤)で染色した。HepG2細胞はHoechst核染色(青)、EthD-1色素(赤)、アポトーシス細胞用NucView色素(緑)で染色した。スタウロスポリンの濃度を変えて、スフェロイドのイメージングで定量した生細胞と死細胞のパーセンテージの濃度依存プロットを以下に示す。HepG2細胞の上清中のVEGF濃度は、同じ実験でELISAにより定量した。
結果
新規マイクロ流体ベースのPu-MAシステムとImageXpressマイクロコンフォーカルシステムを用いたハイコンテント3Dイメージングにより、3Dスフェロイドやマイクロティッシュを用いた自動アッセイを行い、様々な抗がん剤の効果を研究しました。これにより、化合物の効果、腫瘍治療薬、単一スフェロイドやオルガノイドによる成長因子の分泌、代謝プロファイリングのためのサンプルの効率的な処理などを研究するための便利なアプリケーションワークフローが提供されます。
我々は、HCT116結腸癌細胞から形成された癌スフェロイドを用いた3Dアッセイプロトコルを自動化し、選択された抗癌剤の有効性にアクセスした。スフェロイドを封じ込めたフローチップをPu-MAシステムにロードし、それを従来のセルインキュベーターに設置することで、生きた細胞を長時間培養することが可能になった。重要なことは、このシステムによって、自動化された化合物の添加、培地交換、染色、処理を用いたハンズフリー細胞培養プロセスが可能になったことである。様々な培地や試薬がチップのリザーバーにあらかじめロードされ、空気圧を利用して、あらかじめプログラムされた時点で、マイクロ流体チップ内を自動的に移動する。具体的には、48時間の細胞培養プロトコルが自動的に実行され、化合物の再添加を伴う2回の培地交換、生存率色素の添加、培養後の染色試薬の最終洗浄が含まれた。この段階で、スフェロイドはイメージング準備が整った。
フローチップは標準的なプレート寸法を持ち、外部チューブに接続されていないため、様々なイメージング機器やプレートリーダーと互換性があり、イメージングと解析のためにImageXpress® Micro Confocalシステムでイメージングするために、Pu-MAシステム装置から容易に取り出すことができた。
共焦点イメージングにより、スフェロイド構造の3D構造解析と複雑な解析が可能になり、化合物が細胞のサイズ、体積、完全性、全細胞数、生存細胞数、影響を受けた細胞数に与える影響を測定することができた。核、ミトコンドリア、生存率、アポトーシスマーカーの特性評価を可能にするハイコンテントイメージャーを使用することで、高度な画像解析が可能になった。
Pu-MAシステムのマルチリードアウト能力を実証するため、HeLaおよびHepG2がん細胞から作られた2つのがんスフェロイドを追加し、選択された細胞毒性薬剤による治療に対する細胞生存率および細胞死についてアッセイした。HeLaスフェロイドを、コントロールまたは個別にマイトマイシンC(1~100μM)、バリノマイシン(0.1~10μM)またはスタウロスポリン(0.1~20μM)で22時間処理し、2時間染色した後、フローチップ内で画像化した。スタウロスポリンで処理した微小組織の取得画像を図3に示す。コントロールと化合物で処理した場合の全細胞数、生細胞数、死細胞数を画像解析データから求め、プロットに示した。同様に、コントロールまたは異なるスタウロスポリン濃度(0.1~10μM)で44時間処理したHepG2スフェロイドを2時間染色し、画像化した(図3)。異なるスタウロスポリン濃度(0.1μM~10μM)について、生細胞対死細胞のセル数をプロットした。スタウロスポリンで処理したHepG2スフェロイドの培地は、その後の分泌因子分析のためにアッセイ中に回収した。スフェロイド機能の変化は、ELISAを用いて回収した培地中の血管内皮増殖因子(VEGF)レベルを測定することにより評価した。この測定は、スフェロイドのスタウロスポリン処理の効果と良い相関を示した。(図3D)。
Pu-MAシステムは、3D培養の培養、処理、染色および処理という複雑なワークフローを合理化する方法を提供する。また、画質とデータの精度を高めながら、ハイコンテントイメージャーのワークフローとのシームレスな統合を可能にする。
結論
我々は、マイクロ流体Pu-MAシステムとImageXpress® Micro Confocalシステムを組み合わせて使用することで、フローチップ内でin situ染色と3D共焦点イメージングに続いて自動オルガノイド/スフェロイド処理を行うことの利点を実証しました。このシステムは、分泌因子解析を含め、1つのサンプルから複数の読み出しを行うこともできます。
3Dサンプルの自動処理を可能にする合理化されたワークフローを用いて、我々はいくつかの細胞モデルの染色とイメージングにより、異なる薬剤や薬剤濃度に対する反応を示した。このワークフローは、3Dスフェロイドやオルガノイドアッセイ、化合物試験や疾患モデリング、患者由来組織の処理、ex vivoでの薬物に対する患者細胞の感受性試験、患者治療のための個別化アプローチなど、複数のアプリケーションに使用できる。
- Plevniak K. マイクロ流体技術:次世代の創薬ツール。Drug Target Review. https://www.ddw-online.com/precision-medicine/p323447- harnessing-the-modified-proteome-for-increased-diagnosticpower. html (accessed July 20, 2020).
- Huang Y, Streets AM. 研究室内のチップ: 次世代ライフサイエンス研究のためのマイクロ流体工学。2013年1月30日 https://europepmc.org/article/pmc/pmc3574129 (2020年7月20日アクセス)
- Sackmann E, Fulton A, Beebe D. The present and future role of microfluidics in biomedical research. Nature. 2014年3月12日、https://www.nature.com/articles/nature13118?page=43 (2020年8月5日アクセス)
- Gupta N, Liu J, Patel B, et al. マイクロ流体ベースの3D細胞培養モデル: 新規創薬・送達研究における有用性。https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC5689508/ (accessed July 20, 2020).
- Moffat JG, Vincent F, Lee, JA, Eder J, and Prunotto M; Opportunities and challenges in phenotypic drug discovery: an industry perspective. Nat Rev Drug Discov, 2017, 16, 531-543.
- Johnston 2019: Stanton JK, Close DA, Johnston PA. より優れたがん治療薬のリードをスクリーニングするための、384ウェル超低付着性プレーティングで作製した頭頸部扁平上皮カリノーマ多細胞腫瘍スフェロイド培養のハイコンテントスクリーニング特性評価。addt, 2019, 17, 17-36.
- Sirenko 2015: Sirenko O, Mitlo T, Hesley J, Luke S, Owens W, Cromwell EF. 3D 癌スフェロイド培養の生存率と形態を特性化するためのハイコンテントアッセイ。addt, 2015, 13, 402-414
- Hou S, Tiriac H, Sridharan BP, et al. ハイスループット表現型薬物スクリーニングのための原発性膵臓オルガノイド腫瘍モデルの高度な開発。SLAS Discovery, 2018, 23, 574-584.
- Hamilton, E. How Close To End-to-End Automated Drug Discovery? The Science Times. 2020年5月19日 https:// www.sciencetimes.com/articles/25060/20200319/close-endautomated- drug-discovery.htm (2020年7月20日アクセス)
PDF版(英語)