Application Note Organ-on-a-chipモデルにおける
血管新生の3D画像解析と特性評価
- 血管新生の萌芽と構造の3D再構成の可視化
- 萌芽数、総体積、平均強度など、血管新生の定量的評価の実施
- OrganoPlate®プラットフォームを使って生理学的に適切な結果を得る
PDF版(英語)
はじめに
オクサナ・シレンコ博士|シニアリサーチサイエンティスト|モレキュラーデバイス
アンジェリン・リム博士|アプリケーションサイエンティスト|モレキュラー・デバイス
トーマス・オリビエ|バイオインフォマティクス・エンジニア|MIMETAS
血管新生とは、既存の血管から新しい血管や毛細血管が形成され、再形成される生理的プロセスである。これは血管や毛細血管の内皮萌芽や分裂によって達成される。血管細胞は適切な刺激に対して、細胞外マトリックスの分解、内皮細胞の増殖と遊走によって反応する1,2。
細胞はこのような過程を経て、血流と酸素、二酸化炭素、一酸化窒素、栄養素の交換を促進するダイナミックな空間である内腔を封じ込めた管を作り出す。血管新生は、創傷治癒や肉芽組織の形成だけでなく、成長と発育においても重要なプロセスである。血管新生の成長はまた、健康な組織における腫瘍細胞の浸潤をサポートし、がん研究において一般的に測定されている。血管新生が血管新生刺激源に向かって伸長すると、内皮細胞は接着分子を用いて連動して遊走する。これらの萌芽は、セルが血管新生部位に遊走するにつれてループを形成し、完全な血管内腔となる。スプラウトはin vivoでは1日に数ミリの割合で起こり、新しい血管が隙間を横切って成長することを可能にする。
多くの抗血管新生剤が癌治療用に開発されているが、一方、血管新生促進分子は再生への応用の可能性がある。これまでのin vitro実験では、スクラッチアッセイ、ボイデン室、チューブ形成アッセイなど、血管新生メカニズムの一部の側面しかモデル化されていない。MIMETASの研究者たちは、血管新生促進因子あるいは抗血管新生促進因子の指示による、灌流された血管からコラーゲン細胞外マトリックスへの血管の実際の成長と萌芽を含む、より高度で生理学的に適切なモデルを開発した。このような合図は灌流チャンネルのいずれかに加えることができるが、共培養セットアップにおいて組織から直接分泌させることもできる。
ハイコンテントイメージャーは、血管新生構造の可視化、3D構造解析、血管新生と新生血管の萌芽の複雑な解析を可能にする。ここでは、疾患表現型と化合物効果の比較研究に使用できる血管新生の複数の定量的画像記述子を得るためのイメージングと解析方法について述べる。
方法
セルモデル
3D血管新生モデルは、MIMETASのOrganoPlate® 3-lane3,4で構築した。OrganoPlate 3-laneのデザインは、標準的な384ウェルプレートフォーマットに基づいており、各マイクロ流体ユニットは3x3のウェルで表され、合計40ユニットとなっている(図1)。各マイクロ流路は3つの流路で構成されている。コラーゲンI細胞外マトリックス(ECM)ゲルは中央のチャンネルに分注された。フェーズガイドと呼ばれる小さな圧力バリアがECMゲルをパターン化し、隣接する灌流チャンネルへの流入を防いでいる。次に、内皮細胞(初代、セルライン、iPSC由来)を上部の灌流チャンネルに播種し、ECMゲルに対して接着させる。灌流はOrganoPlateをロッカープラットフォームに置くことで開始され、細胞が増殖すると内皮小血管が形成される。血管が形成された後、血管新生促進因子のカクテルを親内皮血管の反対側の底部灌流チャンネルに添加する。その結果、血管新生化合物の勾配が生じ、血管新生の芽が誘導される。血管新生スプラウトは0-4日間形成させ、定量的比較のために固定した。3D血管新生モデルの概略図は補遺にある。

イメージング
血管セルと新芽を4%ホルムアルデヒドで固定し、VE-カドヘリンに対する一次抗体で染色した後、Alexa488二次抗体(緑)で染色した。アクチンフィラメントはActinRed™ ReadyProbes™試薬(赤)で、核はHoechst(青)で染色した。細胞はImageXpress® Micro Confocal High-Content Imaging System(Molecular Devices)を用いてイメージングした。細胞の画像は、共焦点モード(60μmピンホールスピニングディスク)と10Xまたは20X水浸対物レンズを用いて撮影した。20X倍率では、45-58面のZスタック画像を2-4μm間隔で取得した。10X対物レンズでは、15-25画像のZ-スタックを4-6μm間隔で取得した。核はDAPIチャンネルで、血管新芽はFITCチャンネルで、それぞれ100msと400msの露光で撮影した。
画像解析
画像はMetaXpress®ハイコンテント画像取得・解析ソフトウェアのカスタムモジュールエディターを用いて解析した。詳細は結果のセクションに記載されている。簡単に説明すると、神経突起伸長モジュールは新芽の伸長を識別するために使用し、Count Nucleiモジュールは核の特徴付けのために使用した。次に、対物レンズは、"connect by best match "機能を使って3D空間のz平面間で連結された。二次解析は、Microsoft Excelソフトウェアを使って行った。
画像は、MetaXpress環境内の3Dカスタムモジュールを使用して解析された。カスタムモジュールエディター(CME)と3D画像解析機能は、この解析方法に必要である。カスタムモジュールはいくつかのステップを封じ込めた。まず、神経突起伸長モジュールを用いて血管新生スプラウトを定義し、各画像をセグメンテーションした。次に、異なるz平面の対物を "connect by best match "オプションを用いて3D空間で連結した。その後、血管新生スプラウトの数、体積、強度を解析中に定義した。セル核はオプションとして定義され、画像あたりの核の総数またはスプラウトあたりの核の数が計算された。関心領域マスクは、ゲルチャンネルに位置し、内皮チューブチャンネルに位置しない対物レンズのみを含むように解析中に使用した。こうすることで、解析中にカウントされたのは、上側チャンネルのセルではなく、血管新生スプラウトのみであった。開発されたカスタムモジュールは、20Xと10Xの両方の画像で使用できた。あるいは、最大プロジェクション画像を用いて2Dで画像解析を行うこともできる。
新芽の長さを評価するために、"Fibers "アプリケーションモジュール(図示していない)を用いて、少し異なるカスタムモジュールエディターも開発された。
結果
血管新生過程の時間依存性をOrganoPlate 3-laneでモデル化した。上のチャンネルに播種した内皮細胞は3日でチューブを形成した。このモデルには、中央のゲルチャンネルにコラーゲンを入れ、上部のチャンネルライン、あるいは上下両方のチャンネルに形成された内皮細胞のチューブが含まれる(図1)。下部チャンネルに成長因子を加えると、コラーゲンを通して血管新生の芽の形成が促進され、イメージングと解析が可能になった(図2)。
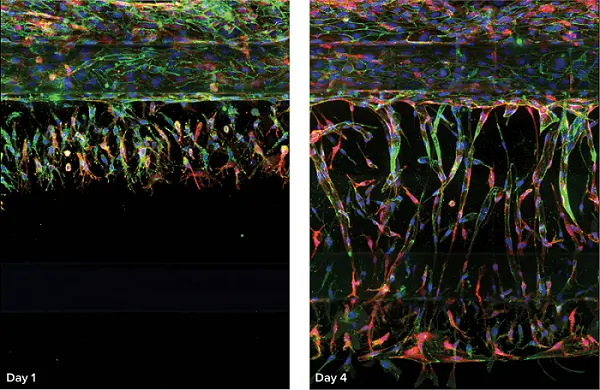
図2に示すように、サンプルは10倍または20倍で撮像された。水浸対物レンズを用いた20X撮影では、固体マトリックス内の細胞をシャープかつ正確に解像することができた。10倍の対物レンズを用いると、対物レンズの細部はあまり解像されないが、1ウェルにつき1部位のみを少ないプレーンで画像取得するため、画像取得はより速くなった。重要なことは、既存の内皮チューブから新生血管の萌芽領域を分離するために関心領域を使用したことである。血管新生萌芽の代表的な画像を図2に示す。
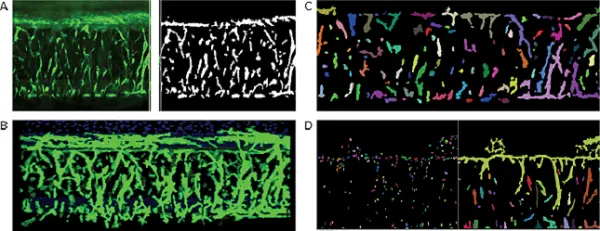
図3は、平面ごとの画像セグメンテーションと、"connect by best match "機能を用いた3Dでの特徴連結を含む画像解析の過程を示している。
新芽の数と体積の時間依存的増加が観察され、セルや核の数も増加した(図4-5)。
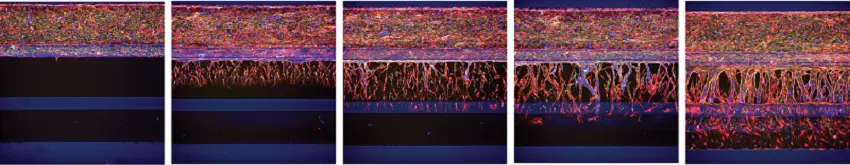
図4.* オルガノプレート3-レーンにおける経時的血管新生萌芽(RFP-HUVECs)。左から右へ、それぞれ0、1、2、3、4日間、下のチャンネルの血管新生カクテルで培養を刺激した結果、血管新生スプラウトが形成された。培養物はアクチン(赤)とVE-カドヘリン(緑)で染色した。核はHoechstで染色した。
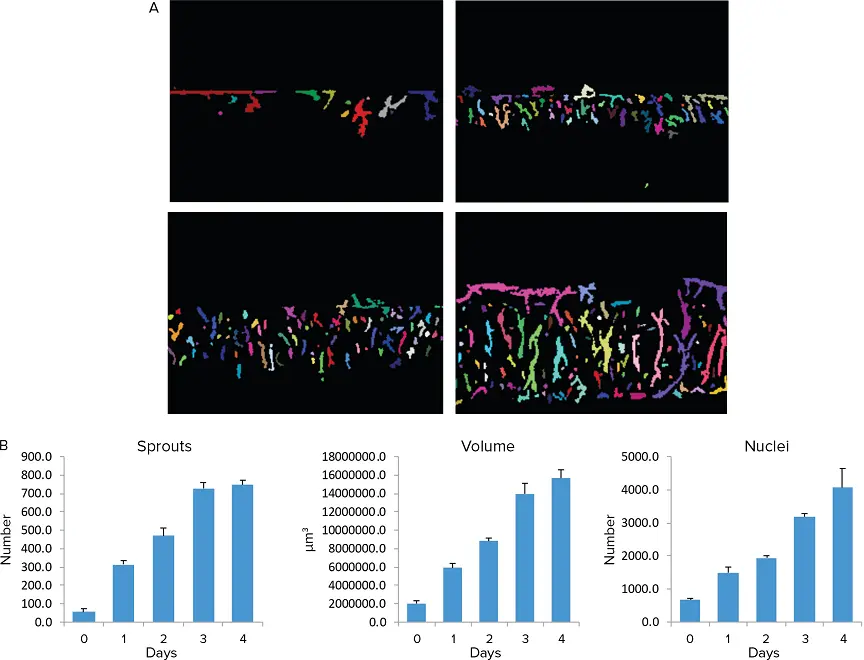
図5.* 血管新生の定量的評価。例は3Dコラーゲン中での4日間連続の血管新生の成長を示す。棒グラフは血管新生の定量的測定を示す。アッセイはトリプリケートで行い、エラーバーはSTDEV*を表す。
プレート全体の画像解析は、ユーザーの介入なしに自動的に実行される。染色強度が大きく異なる場合、実験間で画像強度閾値の追加調整が必要になることがある。解析にはPower Coreの使用が不可欠です。
図6は解析に使用するカスタムモジュールエディターのワークフローを示しています。
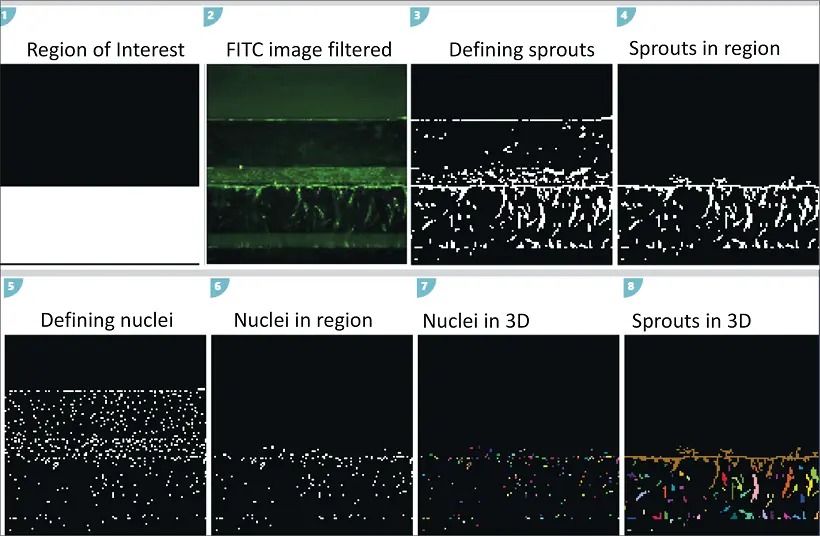
図6.* カスタムモジュールエディター。カスタムモジュールエディター*のステップカード
結論
血管新生のような複雑な生物学的プロセスの表現型変化から定量的データを導き出すことは不可欠である。3Dバイオロジーモデルはヒト生物学の複雑さをよりよく表現しているが、複雑な3D構造解析は困難である。
我々は、MIMETASアッセイにおける血管新生の新芽のキャプチャ、可視化、および定量的解析を可能にするイメージングおよび解析プロトコルを開発し、最適化した。このイメージング・プロトコルはImageXpress® Micro ConfocalシステムとMetaXpress®画像解析ソフトウェア用に開発され、イメージングと解析のための統合されたワークフローを提供する。このシステムとスケーラブルなOrgan-on-a-chipプラットフォームの強みを組み合わせることで、疾患モデリングや化合物スクリーニングのための表現型効果の定量的キャラクタリゼーションが可能になる。
補遺
カスタムモジュールエディターの説明
画像はMetaXpress 6.6ソフトウェアを用いて3D解析した。3Dボリューム内の新芽の数を定量化するために、MetaXpressカスタムモジュールエディター(CME)を用いてカスタマイズ解析を設定した。簡単に言うと、各平面について、新芽を表すFITCチャンネルをガウシアンフィルターで処理した。その後、神経突起伸長オブジェクト解析モジュールを用いてスプラウトをセグメント化した。撮影中に作成されたRegion mask* は、Keep Marked Objectsを使用して中央のゲルチャンネルに成長する新芽を選択するために使用された。Keep Marked Objects は対物レンズなので、Region マスクの外側にあるスプラウトも選択される。あるいは、Keep Marked Objectsを使う代わりに、論理演算ANDを使って、領域マスクの内側にあるスプラウト領域を保持するようにスプラウトを選択することもできる(領域マスクと神経突起伸長オブジェクト)。最後に、Connect by Best Matchアルゴリズムを用いて、各平面からのスプラウトを3Dで接続した。出力測定値には、体積、直径、強度が含まれた。解析スピードを上げるために、MetaXpress® PowerCore™ High-Content 分散画像解析ソフトウェアを使用して、プレート全体の解析を実行した。
* マイクロ流路の中央ゲル流路のみを含むユーザー定義領域を作成するため、画像取得時にカスタムCreate Regionジャーナルを使用した。このジャーナルは、定義された領域を下流解析用の画像マスクに変換します。
3D血管新生モデルの説明
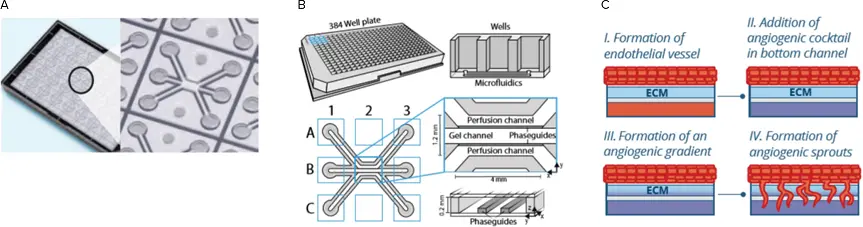
OrganoPlate 3-laneにおける無膜血管新生の形成。A. 40個のチップからなるマイクロ流体デバイス、OrganoPlateの底部。B. 各チップは3つのチャンネルで構成されている:ゲルパターン形成用の1つの「ゲル」チャンネルと隣接する2つのチャンネル。パターニングされたゲルが隣接する流路に流れ込むのを、フェーズガイドが防ぐ。C. 血管新生の新芽形成の模式図。
参考文献
- Birbrair A, Zhang T, Wang ZM, Messi ML, Mintz A, Delbono O (January 2015). "Pericytes at the intersection between tissue regeneration and pathology". 臨床科学。128 (2): 81-93. doi:10.1042/CS20140278. PMC 4200531. PMID 25236972.
- Birbrair A, Zhang T, Wang ZM, Messi ML, Olson JD, Mintz A, Delbono O (July 2014). "Type-2 pericytes participate in normal and tumoral angiogenesis". American Journal of Physiology. セル生理学。307 (1): C25-38. doi:10.1152/ajpcell.00084.2014. PMC 4080181. PMID 24788248
- van Duinen, V., Zhu, D., Ramakers, C. et al. ハイスループットin vitroプラットフォームにおける灌流3D血管新生。Angiogenesis 22, 157-165 (2019).
- Trietsch SJ et al (2013) 成層3D細胞培養のためのマイクロ流体タイタープレート。Lab Chip 13(18):3548-3554.
PDF版(英語)