Application Note がん細胞スフェロイドの3Dイメージング
- 数時間から数日間の環境制御下で細胞の健康動態をモニター
- 迅速なZスタックイメージングによる3Dスフェロイドの再構成
- 入手しやすいプレートと簡単なイメージングワークフローでスフェロイドを研究
PDF版(英語)
はじめに
多くの癌細胞株は、良好な三次元(3D)マトリックス上で培養するとスフェロイドを形成する。これらのスフェロイドは、平らな表面上で増殖するようにプレーティングされた細胞よりも、腫瘍の生理をより忠実に表していると考えられている。Cellable Oncologyマイクロプレート(東洋合成株式会社)のようなマイクロプレートフォーマットでスフェロイドを均一に増殖させる能力により、自動化されたImageXpress® Micro Widefield High Content Imaging Systemを用いたハイコンテンツアッセイで、抗癌剤の有効性をハイスループットでスクリーニングすることができる。その後、MetaXpress® High Content Image Acquisition and Analysis Softwareを使用して、標準アプリケーションモジュールを用いてスフェロイド画像を解析し、生細胞対死細胞の測定、細胞の健康状態の評価、増殖の定量を行うことができる。
Cell-able Oncologyマイクロプレートによるスフェロイド形成
セルアブル・オンコロジー・マイクロプレートに存在する3D表面を用いると、直径100μmの細胞外マトリックス(ECM)コート領域にプレーティングされたがん細胞は増殖し、均一なサイズのスフェロイドを形成します。スフェロイドはウェルボトム表面のECMに接着しているので、免疫蛍光や免疫細胞化学にも適している。96または384ウェル・プレート・フォーマットで増殖させた1ウェル当たり数百個のスフェロイドを、スフェロイドを貫通する複数のz平面で画像を取得し、次に解析のために画像のスタックを単一のベスト・フォーカス画像に折りたたむことにより、標準的な装置構成で迅速に画像化することができる(図1)。

図1. 3Dスフェロイドイメージングのワークフロー。
スフェロイドの大きさは抗がん剤の有効量に影響する
多くの癌細胞株が抗癌剤の細胞毒性評価に使用できる。この実験では、DU145ヒト前立腺ガン細胞をCell-able Oncology Microplates上で1ウェルあたり10,000個または30,000個の細胞で培養し、0.1~1000nMの濃度でパクリタキセル(PTX)を3日間処理した。細胞生存率は、全核を10μM Hoechst 33342で、生細胞のみを2μM Calcein AMで、死細胞核を4μM ethidium homodimer-1 (EthD-1)で染色し、Live/Dead Cell Viability Assayを用いて決定した。プレートを37℃で30分間インキュベートした後、HBSSで洗浄してからイメージングを行った。いずれのアッセイにおいても、PTXは濃度依存的にスフェロイドの細胞生存率を阻害した。1ウェルあたり30,000個の細胞をプレーティングして得られた大きなスフェロイドは、PTX細胞毒性に対してより耐性があった(図2)。
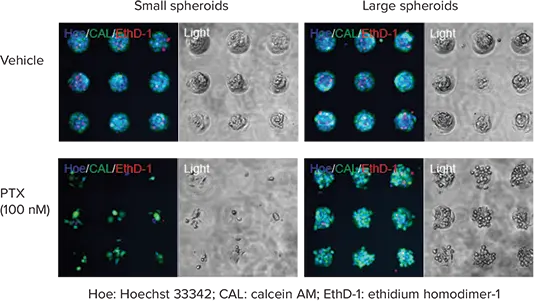
図2. スフェロイドサイズに影響される抗がん剤の有効量。ウェルあたり10,000細胞(左)または30,000細胞(右)でプレーティングしたDU145ヒト前立腺がん細胞のPTX処理後の蛍光Live/Dead Cell viability assayによる細胞生存率の低下の画像。すべての核は青色、生細胞は緑色、死細胞は赤色に着色されている。透過光像は、PTX高用量でのスフェロイドの生存率低下を示す。
アポトーシスとネクローシスのモニタリングにタイムラプスイメージングを使用する
Cell-able Oncology Microplates上で増殖させた癌スフェロイドは、抗癌剤によるアポトーシスとネクローシスの誘導をスクリーニングするのに使用できる。このプロセスをリアルタイムでモニターするために、DU145ヒト前立腺のスフェロイドをPTXまたはカルボプラチン(CBDCA)で処理し、PC9ヒト肺がん細胞をラパタニブで処理した。初期アポトーシスにある細胞を同定するためにCellEvent Caspase-3/7 Green Detection Reagent (CAS)を、壊死細胞を測定するためにethidium homodimer-1 (EthD-1)を添加した後、プレートをImageXpress Micro Systemの環境制御されたチャンバー内に72時間維持し、透過光と蛍光を用いて30分ごとに画像化した。その後、タイムラプス画像をMetaXpressソフトウェアを用いて定量化した。予想されたように、PTXとCBDCAはPC9細胞におけるラパチニブと同様に、DU145細胞においてアポトーシスとネクローシスを誘導した(図3)。
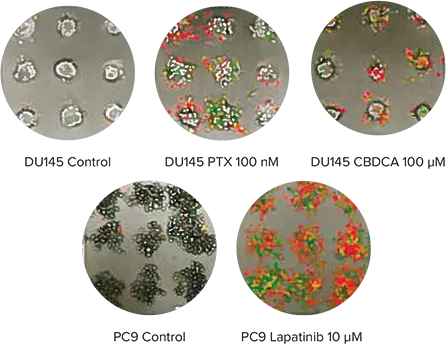
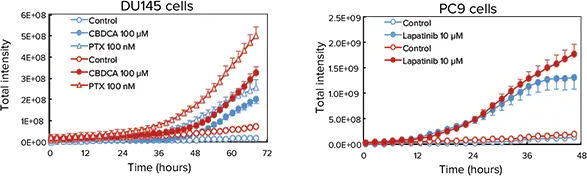
図3. アポトーシスとネクローシスの経時的モニタリング。上:PTXまたはCBDCA処理後のDU145スフェロイド(上)とラパチニブ処理後のPC9スフェロイド(下)におけるアポトーシスとネクローシスを示す3色タイムラプス実験の最終画像。アポトーシス細胞は緑色で、壊死細胞は赤色でオーバーレイ表示されている。下: タイムラプス画像の定量的解析から、CBDCAとPTXはDU145細胞(左下)においてゆっくりとネクローシス(赤色痕跡)を誘導する一方、ラパチニブはPC9細胞(右下)において極めて容易にネクローシス(赤色)とアポトーシス(青色痕跡)の両方を誘導することが示された。
3Dスフェロイドは従来のプレーティング細胞よりも化合物に強い
2D法で培養した細胞は、Cell-able 3Dマトリックスを用いて培養した細胞とは異なる化学感受性を示すことがある。このような感受性の違いをモニターするために、DU-145ヒト前立腺ガン細胞株を従来の2Dマイクロプレートマトリックスと3D Cell-ableマトリックスの両方を用いて培養し、2日後に0.3から1000nMのゲムシタビンで処理した。細胞は薬剤処理後72時間維持され、Click-iT EdU細胞増殖アッセイとエンドポイント測定のためのDAPIで標識された。核染色の減少、EdU取り込みの減少という用量ごとの毒性効果は、モニターした両パラメーターにおいて明らかであった。しかしながら、3Dスフェロイドは、濃度応答のシフトと有意に高いIC50値によって示されるように、化合物に対してより耐性であった(図4)。

図4. 従来のプレーティング細胞とスフェロイドの比較。上図:ゲムシタビンで72時間処理した後、Click-iT EdU細胞増殖アッセイ(赤)およびHoechst核染色(青)で染色した2Dおよび3D培養DU145細胞の画像。スフェロイド像は10X PFluor対物レンズ、1ウェルあたり2フィールド、8 x 5 µm(=40µm)のZスタックで取得した: 核染色またはEdU取り込みにより用量反応を測定。3次元培養細胞は2次元培養細胞よりも高濃度の化合物で毒性反応を示し、ゲムシタビンに対する感受性が低いことが示された。
3Dスフェロイドによる薬剤スクリーニング
in vitro Cell-able 3D 培養システムは、均一なサイズのヒト癌細胞スフェロイドを作製することができ、自動化されたハイスループット、ハイコンテンツイメージングを使用して、治療に対するスフェロイド応答をスクリーニングすることができる。イメージエクスプレスマイクロシステムとメタエクスプレスソフトウェアは、マイクロプレート内の3Dスフェロイドの迅速なイメージングと解析を可能にし、抗がん剤の誘導アポトーシスやネクローシス、細胞毒性のモニタリング、また2D培養細胞と3D培養細胞の化学感受性の違いを比較することができます。
ImageXpress Micro XLS ワイドフィールド高含有量解析システムの詳細はこちら >>
PDF版(英語)