Application Note DAPI染色に代わる方法:生細胞イメージングとカウント
- StainFreeテクノロジーにより、細胞生存率を最大化しながら生細胞計数が可能
- 染色前に必要な固定ステップを排除
- コストのかかる染色手順を回避することで、時間とコストを節約
PDF版(英語)
はじめに
DAPI (4',,6-ジアミノ-2-フェニルインドール)は、核DNAの染色によく用いられる蛍光色素である。蛍光顕微鏡、染色体拡散、FACS、細胞ベースアッセイなどの画像イメージング実験に用いられる[1-4]。しかし、UVで励起するとDAPIが光変換し、イメージングシステムのFITC/GFPチャンネルでDAPIの蛍光が検出されるため、結果の解釈に誤差が生じる[5, 6]。DAPIはまた、最大限の染色のためにセルを固定する必要がある。本ハイライトでは、DAPI染色に代わる方法として、染色が全く不要で生細胞に使用できるStainFreeテクノロジーを紹介する。
SpectraMax® MiniMax® 300イメージングサイトメーター付きMolecular Devices SpectraMax® i3 マルチモードマイクロプレートプラットフォームは、特許取得済みStainFree™ Cell Detectionテクノロジーを使用して細胞を定量化します。この標識不要の方法は、透過光イメージングと洗練されたソフトウェアを使用して、個々の細胞または細胞集団を同定します。ユーザーは、教師ありの機械学習アルゴリズムにより、細胞を識別するようソフトウェアを「ティーチング」することができる。これによって科学者は、細胞を傷つけることなく、またコストのかかる染色手順に時間とコストをかけることなく、細胞を数え、細胞増殖をモニターすることができる。
DAPIに代わるもう一つの方法は、Molecular Devices EarlyTox™ Live Red Dyeです。この細胞透過性の赤色蛍光色素は、生存率に関係なく培養中のすべての細胞の核DNAを染色し、核染色が必要なイメージングアッセイにおいてDAPIの代用として使用できます。励起波長622 nm、ピーク発光波長645 nmのLive Red Dyeは、イメージングアッセイにおいてFITCチャンネルと干渉しない。
我々は、StainFreeテクノロジーとLive Red Dyeを用いた方法とDAPIを用いた方法との比較のため、セルカウント実験を行った。DAPIに代わる方法はいずれも、時間のかかる固定ステップを必要とせずに生細胞をカウントできるという利点をユーザーに提供する。StainFree Technologyは、ユーザーを染色プロトコルの制約から解放し、さらに下流の分析にセルを使用することを可能にする。
方法
CHO-K1細胞を96ウェルプレートに、1ウェルあたり20,000個から300個までの密度でプレーティングし、連続2倍希釈を行い、37℃で一晩接着・増殖させた。培養後、ウェルの一部をリン酸緩衝生理食塩水(PBS)中4%パラホルムアルデヒドで37℃、30分間固定した。固定後、セルを1X PBSで2回洗浄し、0.1% Triton X-100で5分間インキュベートした。細胞をPBSで2回洗浄し、PBS中2.9μM DAPIで30分間染色した。染色後、セルをPBSで3回洗浄した。
残ったセルは生きたまま、Live Red Dyeで染色した。色素のストック溶液をPBSで1:2000に希釈し、セルに加えた。30分間のインキュベーション後、生細胞をMiniMaxサイトメーターの透過光および赤色蛍光(Cy5)チャンネルでイメージングした。StainFree 解析と核数カウントは、SoftMax® Pro ソフトウェアを用いて行った。図1は、StainFreeまたはLive Red Dyeを使用した場合の時間短縮を示している。
比較のため、ImageXpress® Micro XLS ワイドフィールド ハイコンテントイメージングシステムのCy5およびDAPIチャンネルで、生細胞(赤染色)と固定細胞(DAPI染色)をイメージングしました。両方のイメージングシステムでセル数を比較するため、MiniMax サイトメーターで取得した画像に関心領域(ROI)を適用し、ImageXpress Micro XLS システムで撮像した領域と一致させた。グラフはSoftMax Proソフトウェアを用いて作成した。

図1. StainFreeテクノロジーとLive Red DyeとDAPIによるセル解析のワークフロー。StainFreeワークフローでは、DAPIによる固定・染色と比較して約70分の時間短縮が可能。さらに、StainFreeテクノロジーを用いて分析したセルは完全に生存したままであり、追加のアッセイに使用できる。
結果
Live Red Dyeで染色し、MiniMaxサイトメーターの赤色蛍光および透過光チャンネルでイメージングしたセルを図2に示す。赤色蛍光イメージャーでは、SoftMax Proソフトウェアであらかじめ定義された「Nuclei」設定を使用して、染色された核を正確に同定した。透過光チャンネルでイメージングしたセルについては、StainFree Technologyを使用して細胞を同定した。これらのCHO細胞では、ソフトウェアの事前定義設定「セルA」が最も正確な結果を得た。StainFree細胞カウントは蛍光核カウントと非常に近いアライメントを示し(図2、グラフ)、MiniMaxサイトメーターとSoftMax® Proソフトウェアが、細胞を正確にカウントするために核染色を必要としないことを実証した。

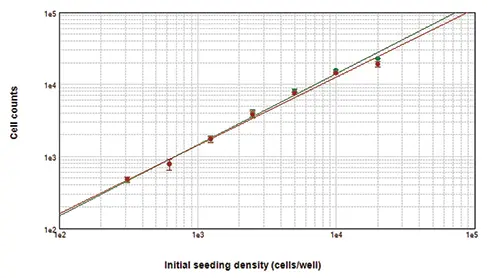
図2. MiniMaxサイトメーターでカウントしたセル。Live Red Dyeで染色したセルを赤色蛍光イメージャー(左上)または透過光イメージャー(中央上)でイメージングした。StainFree細胞数(右上、紫色マスク)は、グラフに示すように、赤色核染色に基づく細胞数と非常に密接に相関している(緑色丸はStainFree細胞数、赤色丸は赤色核細胞数)。両曲線のr2値は0.99であった。
DAPI染色細胞は、ImageXpress Micro XLSシステムとMetaXpress® ソフトウェアを用いてイメージングし、カウントした。比較のために、Live Red Dyeで染色した細胞を、Cy5チャンネルを用いて同じシステムでイメージングした。染色細胞のイメージングを図3に示す。両染料によるセルカウントは非常によく一致した(図3、グラフ)。この比較から、DAPIを用いたセルカウントはStainFree Technologyを用いたセルカウントと同等であることが確認された。
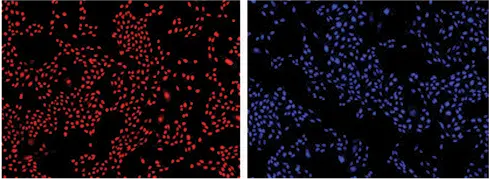

図3. ImageXpress XLSシステムでカウントしたセル。Live Red Dye(左上)またはDAPI(右上)で染色されたセルがイメージングされ、SoftMax Proソフトウェア(下)でグラフ化することにより、両染料で得られたカウントの密接な相関が示された。どちらの曲線でもr2は0.99であった。
結論
StainFree TechnologyとLive Red Dyeは、染色前に固定が必要なDAPIと同程度の細胞数をカウントするのに有効である。StainFree細胞計数は、蛍光色素も固定も必要ないため、細胞生存能を最大化し、細胞ハンドリングに費やす時間を最小化するための最良の選択である。核のサイズや染色レベルをモニターするためなど、核染料が必要な場合は、Live Red DyeをDAPIの代わりに使用できますが、固定は必要ありません。また、DAPIのように緑色蛍光イメージャーを妨害することもありません。StainFree TechnologyまたはLive Red Dyeのいずれかを使用することで、ライブセルベースアッセイの汎用性が高まり、実験結果の信頼性が高まります。
参考文献
- https://www.lifetechnologies.com/order/catalog/product/D1306
- Otto F. 1990年。核DNAの高分解能フローサイトメトリーに4.おける固定細胞のDAPI染色。Methods in Cell Biology 33: 105-110.
- Kapuscinski J. 1995年。DAPI:DNA特異性蛍光プローブ。Biotechnic & Histochemistry 70(5): 220-233.
- Chazotte B. 2011年。DAPIを用いた核DNAの標識。Cold Spring Harb Protoc; 2011; doi:10.1101/pdb.prot5556.
5.North AJ. 2006. 百聞は一見に如かず?画像取得における実践的落とし穴の初心者ガイド。J. Cell Biology 172(1): 9-18. - North AJ. 2006. 百聞は一見に如かず?画像取得における実践的落とし穴の初心者ガイド。J. Cell Biology 172(1): 9-18.
- Jez M, Bas T, Veber M, Kosir A, Dominko T, Page R, Rozman P. 2012. DAPI光電変換の危険性:色素、マウントメディア、固定液の影響と問題を最小限に抑える方法。Histochem. Cell Biol: 195-204.
SpectraMax® MiniMax® 300イメージングサイトメーターについてさらに詳しく >>
PDF版(英語)