Application Note 自動細胞イメージングを用いた
アポトーシスの解析
- 簡素化された、洗浄不要の均一性アッセイを用いてアポトーシスを評価。
- イで画像を取得・解析し、結果を迅速に得ることができます。
- あらかじめ設定された解析モジュールを用いて、細胞の健康状態をモニターし、アポトーシスを定量化する。
PDF版(英語)
はじめに
マシュー・ハマー、オクサナ・シレンコ博士|アプリケーションサイエンティスト|モレキュラー・デバイス
アポトーシスは、多細胞生物で起こるプログラムされた細胞死のプロセスである1,2。生化学的な事象は、細胞の形態と細胞死に特徴的な変化をもたらす。形態学的変化には、細胞の収縮、核のフラグメント、クロマチンの凝縮、染色体DNAの断片化、mRNAの崩壊などが含まれる。アポトーシスは高度に制御されたプロセスであり、飢餓、感染、低酸素、酸化ストレスなどを含む様々なストレス因子への応答として、内在性経路を介して開始される。アポトーシスの開始には、ミトコンドリアの損傷が重要な役割を果たしている。外因性経路では、アポトーシスは腫瘍壊死因子受容体ファミリーを介したシグナル伝達を含む外部シグナルによって開始される。どちらの経路もカスパーゼ酵素を活性化することによって細胞死を誘導する。アポトーシスの制御における障害は、癌を含む様々な疾患に関与している3。ここでは、自動細胞イメージングを用いたアポトーシス検出のための細胞ベースアッセイについて述べる。
材料
- HeLa細胞(ATCC P/N CCL-2)
- HeLa培地
- DMEM:CellGro、L-グルタミン入り(コーニング)
- 10% FBS (BenchMark™; Gemini P/N 100-106)
- 1% ペニシリン/ストレプトマイシン
- スタウロスポリン(Sigma P/N S5921)
- マイトマイシンC(Sigma P/N M4287)
- カンプトテシン(Sigma P/N C9911)
- EarlyTox Caspase-3/7 NucView 488 Assay Kit(Molecular Devices P/N R8348)
- 96ウェル黒色透明底マイクロプレート(Greiner P/N 655090)
- ImageXpress Pico 自動細胞イメージングシステムおよび CellReporterXpress 自動イメージング・解析ソフトウェア

方法
ヒト子宮頸がん細胞株であるHeLa細胞を、黒色透明底96ウェルGreinerマイクロプレートに1ウェル当たり5,000個プレーティングし、37℃、5%CO2で一晩培養した。翌日、アポトーシスを誘導するために、異なる濃度の抗がん化合物-スタウロスポリン、マイトマイシンC、またはカンプトテシンで細胞を4回処理した。各化合物の最高濃度は10μMスタウロスポリン、200μMマイトマイシンC、100μMカンプトテシンであった。処理後18時間目に、細胞をEarlyTox™ Caspase-3/7 NucView 488色素とEthidium Homodimer IIIで30分間染色し、最終1倍濃度はそれぞれ5μMと3μMとした。その後、Hoechst 33342核染料を最終濃度6μMとなるように各ウェルに添加し、細胞を37℃、5%CO2インキュベーターに15分間戻した。
アーリートックス カスパーゼ-3/7 NucView 488アッセイキット
カスパーゼ-3とカスパーゼ-7はアポトーシスの実行段階で活性化されるプロテアーゼである。EarlyToxキットのカスパーゼ-3/7 NucView 488基材は、インタクト細胞内のカスパーゼ-3/7活性を検出するために使用される。この基質は、カスパーゼ-3/7 DEVD認識配列に結合した蛍光性DNA色素からなる。最初は無蛍光であるが、基質は細胞膜を透過して細胞質に入る。アポトーシス細胞では、カスパーゼ-3/7が基材を切断し、細胞核に遊走してDNAに結合する高親和性DNA色素を放出する。500 nmで励起すると、530 nmで明るい緑色の蛍光を放出し、カスパーゼの活性化レベルを評価するのに使用できる。全細胞数の評価にはHoechst 33342核染料を、死細胞(外膜が破壊された細胞)の数にはEthidium Homodimerを用いた。
自動細胞イメージングによるアポトーシス評価
染色後、ImageXpress® Pico自動細胞イメージングシステムを用い、対物レンズ10Xで生細胞をイメージングした。画像は、DAPI、FITC、TRITCチャンネルを用い、それぞれ20、500、50msの露光時間で、ウェルあたり1部位ずつ取得した。図1は、コントロール細胞と、0.3 µM staurosporineと10 µM mitomycin Cで処理した細胞の画像である。
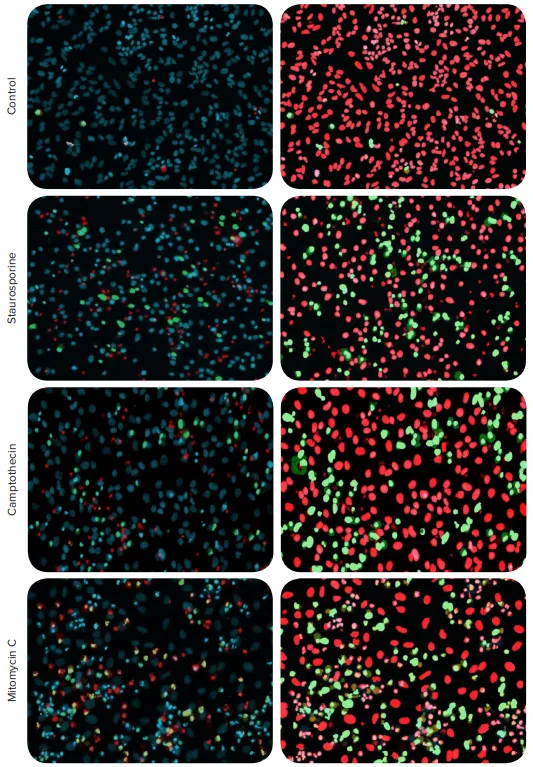
図1. 自動細胞イメージングを用いたアポトーシスの検出。HeLa細胞を抗がん化合物で処理した。代表的な画像の化合物濃度は0.3 µMスタウロスポリン、66 µMカンプトテシン、22 µMマイトマイシンCである。細胞はEarlyTox Caspase-3/7 NucView 488 Assay KitとHoechst核染料およびEthidium Homodimer IIIを組み合わせて染色した。左パネルに示す合成画像:核染色Hoechstは青、アポトーシス核は緑、死細胞核は赤で示す。アポトーシス解析のオーバーレイマスクを右側に示す:アポトーシス核(緑)と非アポトーシス核(赤)。
Hoechst核染色は青色、アポトーシス核は緑色、死細胞の核は赤色で示す。CellReporterXpress画像取得・解析ソフトウェアのアポトーシス解析プロトコルとフライでの画像取得を併用し、カスパーゼ染色で示されるアポトーシス細胞の数と割合を評価した。さらに、Ethidium Homodimer染色も死細胞の数と割合を検出するために使用することができ、Hoechst染色は全細胞を定義するために使用した。その結果、アポトーシスと細胞死誘導の濃度反応曲線が、測定されたEC50値とともに図2に示された。注目すべきことに、強力なアポトーシス誘導剤として知られるキナーゼ阻害剤スタウロスポリンのEC50は、異なる細胞メカニズム(生還元的アルキル化)によって抗がん効果を誘導するマイトマイシンCのEC50よりも約100倍低かった。
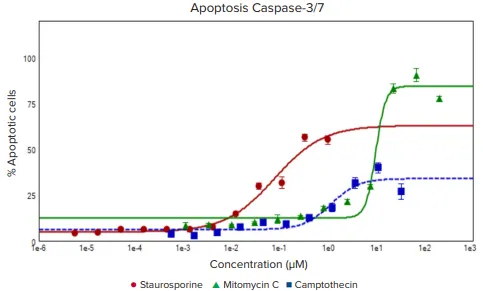
図2. 3種の抗がん化合物の濃度反応。アポトーシス細胞の割合:スタウロスポリン(赤、EC50 0.076μM)、マイトマイシンC(緑、EC50 9.669μM)、カンプトテシン(青、EC50 1.14μM)。
結論
EarlyToxアッセイキットは、疾患の生物学的製剤の研究、抗がん剤の評価、細胞の健康状態のモニタリングに有用です。これは、アポトーシスの評価と定量におけるImageXpressPicoシステムとCellReporterXpressソフトウェアの有用性を示すものである。
参考文献
- Green, Douglas (2011). エンドツーエンドへの手段: アポトーシスとその他の細胞死メカニズム。Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-888-1.
Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2008). - 細胞の分子生物学。(第5版)。第18章 アポトーシス: プログラムされた細胞死が不要なセルを排除する。ガーランドサイエンス. ISBN 978-0-8153-4105-5.
- Karam, Jose A. (2009). Apoptosis in Carcinogenesis and Chemotherapy. オランダ: Springer. ISBN 978-1-4020-9597-9.
- Verweij J1、Pinedo HM. マイトマイシンC:作用機序、有用性、限界。Anticancer Drugs. 1990 Oct;1(1):5-13.
PDF版(英語)