Application Note 磁気バイオプリントHepG2スフェロイドにおける
アポトーシスのアッセイ
- 最短15分でスフェロイドを磁気バイオプリント
- スフェロイドを平底マイクロプレートウェルの中央に配置し、迅速な1サイトイメージングが可能。
- ホモジニアス蛍光アッセイにより、1時間以内にスフェロイドのアポトーシスを評価。
PDF版(英語)
はじめに
Cathy Olsen, PhD | Sr. Applications Scientist | Molecular Devices
二次元(2D)細胞培養は、幅広い細胞プロセスを調べるために1世紀以上にわたって用いられてきた。しかし、より最近の研究では、2D系での応答が生体内で見られる応答と大きく異なる場合があることが示されている(Duval et al.) 2D培養を3Dスフェロイドに形質転換する様々な方法が考案されているが、その多くはスフェロイド形成に長時間を要し、取り扱いが困難である。
Greiner Bio-One社の384-Well Bioprinting Kitは、最大3週間培養を維持できるスフェロイドを迅速に形成する簡単な方法を提供する。二次元培養で増殖しているセルは、まず金、酸化鉄、ポリ-L-リジンからなるナノ粒子集合体であるNanoShuttle™-PLで処理され、磁化される。その後、細胞をトリプシン処理し、撥細胞性の384ウェルプレートに移す。このプレートは、プレートのウェルの下に配置された384個の磁石からなるスフェロイドドライブの上にプレーティングされ、磁化された細胞が15分から数時間かけてウェルの底に磁石の形に凝集する。その後、プレートをインキュベーターに保ち、スフェロイドを様々な実験条件下で処理することができる。
ここでは、Greiner Bio-One社の磁気3D細胞培養システム(m3D)を用いて、HepG2細胞をどのようにバイオプリントできるかを示す。得られたスフェロイドはアポトーシスを誘導する化合物で処理され、Molecular Devices EarlyTox™ Caspase-3/7-D NucView 488 Assay Kitを用いてアッセイされる。スフェロイドは、SpectraMax® i3x マルチモードマイクロプレートリーダーとSpectraMax® MiniMax 300イメージングサイトメーターでイメージングし、結果をSoftMax® Proソフトウェアで解析することで、定量結果が得られます。
材料
- 384-Well Bioprinting Kit (Greiner Bio-One m3D cat. #781840 or 781841) には以下が含まれます:
・NanoShuttle-PL (600μLバイアル2本)
・384-Well スフェロイドドライブ (1)
・384ウェルホールディングドライブ(1)
・Greiner Bio-One 384-Well Cell Culture Microplate with Cell-Repellent Surface with Flat bottom(2枚;781840は透明マイクロプレート、781841はBlack with μClear ® bottomを含む。) - HepG2 ヒト肝細胞癌細胞株(ATCC cat.)
- イーグル最小必須培地 (ATCC cat. #30-2003)
- BenchMark™ ウシ胎児血清 (Gemini Bio-Products cat. #100-106)
- ペニシリン-ストレプトマイシン(10,000 U/mL、ThermoFisher cat.)
- スタウロスポリン(Sigma cat.)
- アニソマイシン(Sigma cat.)
- EarlyTox Caspase-3/7-D NucView 488 Assay Kit(Molecular Devices社のカタログ番号R8348)
- SpectraMax i3x マルチモードマイクロプレートリーダー(Molecular Devices cat.)
・SpectraMax MiniMax 300イメージングサイトメーター(Molecular Devices社カタログ#MINIMAX 300)
方法
HepG2細胞の培養
HepG2ヒト肝細胞がんセルは、10%ウシ胎児血清(FBS)と1%ペニシリン/ストレプトマイシンを添加したイーグル最小必須培地(EMEM)で培養した。スフェロイド形成の準備として、細胞をT-25培養フラスコで80%コンフルエンスまで培養した。その後、以下のようにナノシャトル-PLで処理した:
-
ナノシャトル-PLを室温で少なくとも15分間放置した。ナノシャトル-PL を室温で少なくとも 15 分間静置した。
-
NanoShuttle-PL を室温で少なくとも 15 分間静置した。NanoShuttle-PL をバイアル中で少なくとも 10 回ピペッティングしてホモジニアス化した。
-
200μLのNanoShuttle-PLをT-25フラスコの培地に直接添加し、セルを37℃で一晩培養した。
スフェロイド形成
翌日、磁気スフェロイドドライブを70%エタノールで拭き取り、無菌状態を保つためにバイオセーフティキャビネットに入れた。ナノシャトル-PL中で一晩インキュベートしたHepG2セルをトリプシン処理した後、細胞数を数え、培地1mLあたり20,000個になるように再懸濁した。細胞撥水性の384ウェルプレートを384ウェルスフェロイドドライブの上にプレーティングした。細胞懸濁液を1ウェル当たり50μLずつプレートに播種し、細胞プレートをマグネットドライブの上に15~30分間置くと、各ウェルの底に磁石の形に細胞が凝集(プリント)した。
バイオプリンティング後、プレートをスフェロイドドライブから外し、インキュベーターに移した。バイオプリンティング後2日目と5日目に、SpectraMax® MiniMax® 300イメージングサイトメーターの透過光(TL)チャンネルを使用してスフェロイドをイメージングした(設定は表1に示す)。プレーティングの前に、スフェロイドを各ウェルの中央に配置するため、プレートは保持ドライブに置かれた。これにより、1ウェルあたり1部位を使用して、各ウェルで1つのスフェロイドをイメージングすることが可能になった。
| 透過光 | パラメータ | 蛍光 |
|---|---|---|
| 光学構成 | ミニマックス | |
| 読み取りモード | イメージング | |
| 読み取りタイプ | 終点 | |
| 波長 | 透過光 | 蛍光 励起波長:456 nm 発光波長:541 nm |
| プレーティングタイプ | 384ウェルグライナーblk/clrbtm*プレート | |
| 読み取り領域 | [撮像するウェルを選択] | |
| ウェルエリア設定 | 1 サイト | |
| 画像取得設定 | 露光: 7 ms フォーカス調整 100 μm |
露光: 11 ms フォーカス調整 100 μm |
*SoftMax Proソフトウェアに記載されているプレーティングタイプ 表1. MiniMax サイトメーターでスフェロイドの画像を取得するために使用した設定。印刷後2日目と5日目にスフェロイドの透過光(TL)画像を収集したときの設定を示す。蛍光設定は、EarlyTox Caspase-3/7-D NucView 488 Assay Kitでアッセイした化合物処理スフェロイドの画像に使用した。
化合物処理
HepG2細胞にアポトーシスを誘導することが知られている化合物であるアニソマイシンとドキソルビシンを培養液で希釈し、スフェロイドに添加する作業溶液を作製した。アニソマイシンの作業溶液は、25μMから0.01μMまで、1:3の希釈系列で作られた。ドキソルビシンの作業溶液は3μMから0.0001μMまで、1:3希釈系列で作成した。スフェロイドのバイオプリンティング後5日目に、スフェロイドを封じ込めたプレートをホールディングドライブ上に置き、ウェル底にスフェロイドを維持しながら、ウェルから培地を除去し、アニソマイシンまたはドキソルビシンのワーキング溶液と交換した。細胞を化合物で4日間処理した。化合物処理後、アポトーシスをアッセイした。
アポトーシスアッセイ
EarlyTox Caspase-3/7-D NucView 488 Assay Kitを用いて、化合物処理4日後の各スフェロイドのアポトーシス活性レベルを測定した。DMSO 中の NucView 488 Caspase-3 基質の 1 mM ストックを培養液で 7.5 μM に希釈し、スフェロイドに添加した。セルを遮光し、室温で15-30分間インキュベートした。
SpectraMax® MiniMax® 300イメージングサイトメーターで、541 nmの緑色蛍光チャンネルを用いてイメージングを行った(設定は表1に示す)。画像はSoftMax Proソフトウェアを用いて収集・解析した。スフェロイドを解析するために、Set Size and Intensity設定を使用し、最小幅を200μm、最大幅を1000μmに設定した。Intensity Above Backgroundは200に設定した。これらの設定により、スフェロイドのみが解析され、他のセルや残骸は解析されないことが確認された。
結果
印刷されたHepG2スフェロイドは真円性でコンパクトな構造を形成し、数日間培養を維持できたため、化合物処理のスケジュールを柔軟に設定できた。印刷から48時間後または5日後にスフェロイドを撮影した画像は、細胞配列の進行を示している(図1)。
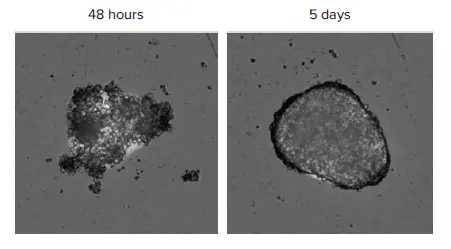
図1. MiniMaxサイトメーターのTLチャンネルでイメージングしたスフェロイド。スフェロイドのバイオプリントから48時間後または5日後に同じウェルの画像を撮影した。
スフェロイドをアニソマイシンまたはドキソルビシンで処理すると、濃度依存的にアポトーシスが誘導された。EarlyTox Caspase-3/7-D NucView 488 Assay Kitを用いてアポトーシス細胞の核を緑色に蛍光染色し、MiniMaxサイトメーターで容易に検出した(図2)。スフェロイドの総蛍光強度を分析し、アポトーシス活性の総量を示した(図3)。
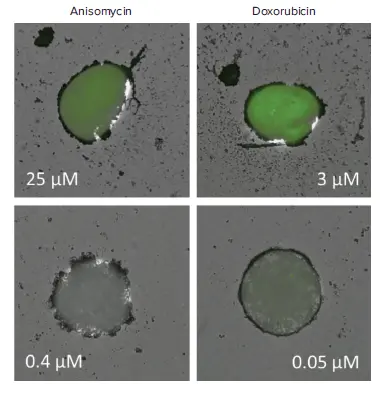
図2. TLと蛍光イメージャーの重ね合わせ。スフェロイドを高濃度(上段)または低濃度(下段)のアニソマイシンまたはドキソルビシンで処理し、EarlyTox Caspase-3/7-D NucView 488 Assay Kitを用いてアッセイした。TLチャンネルと緑色蛍光チャンネルで撮影した画像を重ね合わせた。
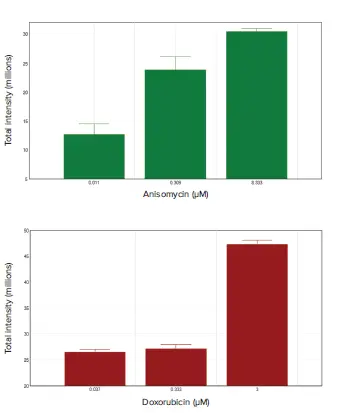
図3. アニソマイシンおよびドキソルビシン処理スフェロイドにおけるアポトーシスの解析。EarlyTox Caspase-3/7-D NucView 488 Assay Kitでアッセイし、MiniMaxサイトメーターでイメージングした後、スフェロイドの総蛍光強度をSoftMax Proソフトウェアで化合物濃度に対してプロットした。ここでは低濃度、中濃度、高濃度の化合物を示した。
結論
スフェロイド・バイオプリンティングは、細胞を三次元構造体に凝集させる迅速な方法であり、細胞単層で培養した細胞よりも優れた生物学的関連性を提供する。細胞単層培養で増殖させたHepG2細胞を磁化し、m3Dシステムを用いてバイオプリントし、得られたスフェロイドをEarlyTox Caspase-3/7-D NucView 488 Assay Kitを用いてアポトーシスをアッセイした。MiniMaxサイトメーター付きSpectraMax i3xリーダーにより、1ウェルあたり1部位のスフェロイドを効率的にイメージングし、SoftMax Proソフトウェアでアポトーシスを定量解析することができた。
参考文献
Duval K, Grover H, Han LH, Mou Y, Pegoraro AF, Fredberg J, and Chen Z. 'Modeling physiological events in 2D vs. 3D cell culture.'. Physiology (2017); 32(4): 266-277.
PDF版(英語)