Application Note 比色分析による細胞生存率と増殖の評価
- 簡便な比色分析が可能
- サンプルあたりわずか300セルのアッセイ
- 単一試薬代替法で作業時間を短縮
PDF版(英語)
はじめに
ジョイス板谷|アプリケーションサイエンティスト|モレキュラー・デバイス
Cathy Olsen, PhD|Sr.アプリケーションサイエンティスト|モレキュラーデバイス
MTTのようなテトラゾリウム塩は、細胞の代謝活性を評価する比色分析アッセイに長い間採用されてきた。生存可能なセルは、黄色のMTT(3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド)を不溶性の紫色ホルマザンに変換する酵素を産生する。サンプル中の生存セルが多いほど、紫色は濃くなる。このホルマザンは、第二の試薬を加えることで可溶化され、サンプルの吸光度をマイクロプレートリーダーで590 nmで測定することで、細胞生存率や増殖を簡便に読み取ることができる。
MTTアッセイは簡便ではあるが、試薬の添加とインキュベーションのステップが2回必要であり、時間が限られている場合やサンプル数が多い場合には、その魅力は減少する。ここでは、AbcamのMTTアッセイと、同じくAbcamの比色分析Cell Cytotoxicity Assayを比較する。このアッセイは、細胞の還元によって吸収スペクトルが変化する特許取得済みの水溶性色素を使用する。このアッセイでは、単一の試薬を細胞に添加し、インキュベーション後、吸光度を570nmと675nmで測定する。吸光度比(OD570/OD675)はサンプル中の生存細胞数に比例する。
MTTキットと細胞毒性キットは、どちらも細胞増殖(生細胞)と細胞毒性を測定するために使用できます。その選択は、主に希望するワークフローと所要時間に基づいて行われる。HeLa細胞の希釈系列を96ウェルプレートにプレーティングし、両キットでアッセイすることにより、生存細胞数の範囲を検出した。細胞毒性は、酵素トポイソメラーゼ2を阻害することによりがん細胞の増殖を停止または減速させる化学療法薬であるドキソルビシンで処理したHeLa細胞をアッセイするために、両方のキットを用いて測定した。MTTアッセイと細胞毒性アッセイの両方を、96ウェルマイクロプレートを10秒未満で読み取ることができるSpectraMax® ABS Plusマイクロプレートリーダーで読み取りました。細胞毒性アッセイを使用すると、アッセイ時間全体を最大70%短縮できる(図1)。
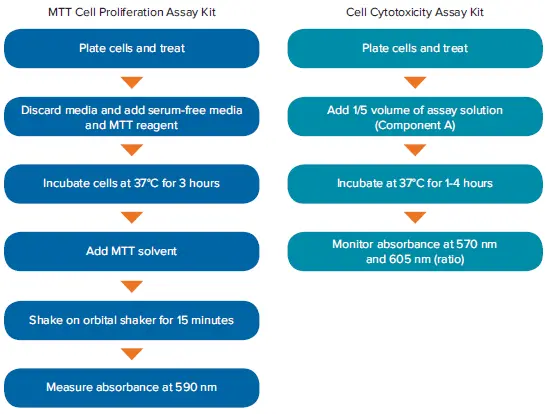
図2. MTT 細胞増殖アッセイキットと細胞毒性アッセイキットのワークフロー。細胞毒性アッセイキットは、試薬の添加とインキュベーション時間を短縮することで、アッセイ時間全体を最大70%短縮します。
方法
使用したキットおよびその他の材料
- MTT Cell Proliferation Assay Kit (Abcam cat. #ab211091)
- 細胞毒性アッセイキット-比色分析 (Abcam cat. #ab112118)
- ドキソルビシン (Tocris cat. #2252)
- HeLa細胞 (ATCC cat. #CCL-2)
- コーニング 96 ウェル黒色マイクロプレート(透明底) (Corning cat. #3603)
- SpectraMax ABS Plus マイクロプレートリーダー(Molecular Devices 社 cat.)
アッセイ前のセルプレーティングと処理
広範囲の生存細胞数を検出するアッセイ能力を検証するため、一連の細胞密度を設定した。HeLa細胞を、底が透明で壁が黒色の96ウェルマイクロプレートに、1ウェルあたり156~10,000細胞でトリプリケートプレーティングした。データ解析に使用するため、培地のみ(細胞なし)を封じ込めたコントロールウェルも用意した。セルは37℃、5% CO2で一晩接着させ、増殖させた。
化合物で処理した細胞の細胞毒性を測定するため、HeLa細胞を1ウェルあたり10,000細胞プレーティングし、37℃、5% CO2で一晩接着・増殖させた。翌日、30μMから0.12μMまでの濃度で、1:2希釈系列でドキソルビシンをトリプリケートウエル中の細胞に添加した。1)細胞と既知の細胞毒性誘導物質(ドキソルビシン)を含む陽性対照、(2)細胞を含むが被験物質を含まない陰性対照、(3)細胞と被験物質導入に用いたビヒクル(DMSO)を含むビヒクル対照、(4)細胞を含まない増殖培地を含む非細胞対照。セルは37℃、5% CO2で一晩処理した。
どちらのキットも、ドキソルビシン処理細胞における細胞毒性だけでなく、生存細胞密度シリーズのアッセイに使用された。
MTTアッセイ手順
セル上の培地を吸引し、50μLのフェノールレッドフリー無血清培地と交換した。50μLのMTT試薬を各ウェルに添加した。プレートを30秒間シェーカーにかけ、37℃、5% CO2で3時間インキュベートした。その後、150μLのMTT溶媒を各ウェルに加え、ホルマザン生成物を可溶化し、プレートを15分間シェーカーにかけた。SpectraMax ABS/ABS Plusマイクロプレートリーダーで吸光度を590 nmで読み取った。
細胞毒性測定手順
マイクロプレートの各ウェルに20μLのComponent Aを添加した。プレートを15秒間シェーカーにかけ、37℃、5% CO2で2時間インキュベートした。SpectraMax ABS/ABS Plusマイクロプレートリーダーで、吸光度(光学密度、OD)を570 nmおよび605 nmで読み取った。各サンプルについて、吸光度値はOD570/OD605比で表した。
増殖および細胞毒性データ解析
MTTアッセイ
MTTアッセイでは、細胞密度が異なるサンプルは、細胞を封じ込めたウェルの吸光度値から細胞無しのコントロール(バックグラウンド)の吸光度値を差し引くことでバックグラウンド補正を行った。結果は、ウェルあたりの細胞数に対する吸光度値としてプロットした。
細胞に対するドキソルビシン処理の効果は、以下の式を用いて算出した:
細胞毒性 = (100 X (コントロール - サンプル)) / コントロール。/ コントロール
ここで、コントロールは未処理細胞の吸光度値である。
細胞毒性アッセイ
細胞毒性アッセイ 細胞毒性アッセイ 細胞毒性アッセイ 細胞毒性アッセイ 細胞毒性アッセイでは、増殖(細胞密度系列)を、細胞ウェルの値から無細胞コントロールの平均吸光度値(比)を差し引くことで解析した。ドキソルビシン処理細胞の細胞毒性結果は、MTTアッセイで用いたのと同じ式を用いて計算した:
細胞毒性 = (100 X (コントロール - サンプル)) / コントロール。/ コントロール
すべての計算は、SoftMax® Proソフトウェアのテンプレートエディターとグループテーブルを使用して設定し、結果はベストカーブフィットを使用してプロットした。
結果と結論
細胞希釈系列データを、バックグラウンド補正した吸光度値とウェルあたりの細胞数でプロットした(図2)。どちらのアッセイも、96ウェルプレートで1ウェルあたり10,000個からわずか156個までの細胞密度を容易に測定できる。
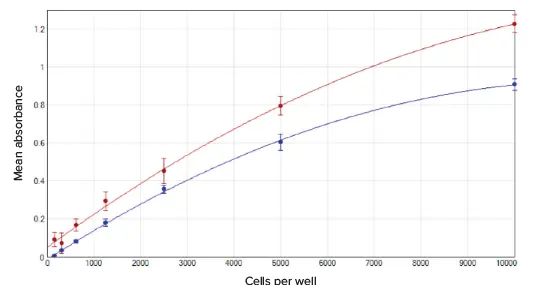
図2. SoftMax® Proソフトウェアの二次曲線フィットを用いてグラフ化した、吸光度の平均値とウェルあたりの細胞数。青のプロットはMTTアッセイ(r2 = 0.999)、赤のプロットは細胞毒性アッセイ(r2 = 0.998)。
ドキソルビシン処理細胞の%細胞毒性値をドキソルビシン濃度に対してプロットした(図3)。MTTアッセイでは3.1μMのIC50値が得られ、細胞毒性アッセイでは2.1μMという同様の値が得られた。
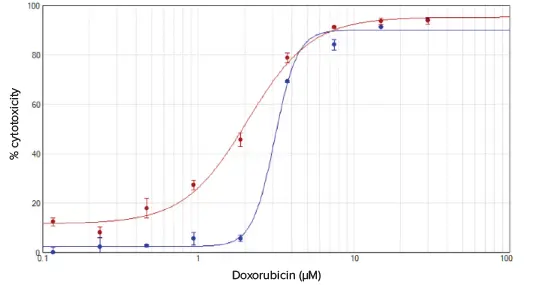
図3 MTTアッセイ(青プロット)と細胞毒性アッセイ(赤プロット)を用いたドキソルビシン処理細胞の細胞毒性%。データはSoftMax® Proソフトウェアの4パラメータカーブフィットを用いてプロットした。同様のIC50値は、それぞれ3.1μMと2.1μMであった。
MTT細胞増殖アッセイと細胞毒性アッセイの両方を用いて、(a)広範囲の細胞密度にわたって生存率を評価し、(b)ドキソルビシンで処理した細胞の細胞毒性を測定した。各アッセイとも同様の結果が得られたが、細胞毒性アッセイは単一試薬でインキュベーション時間が短縮されるため、時間短縮という利点がある。どちらのアッセイも、SpectraMax ABS Plusマイクロプレートリーダーで使用できる吸光度ベースの検出を使用して化合物の効果をスクリーニングし、SoftMax Proソフトウェアで結果を計算してプロットすることができます。
PDF版(英語)