Application Note 自動細胞イメージングによるCFPタグ付き核タンパク質の導入効率の評価
- CFP波長域の蛍光色素を用いたマルチカラーアプリケーションの実行
- 明視野で捕捉したセルの解析
- 事前に設定された解析モジュールでトランスダクション効率を定量化
- On-the-fly解析で画像を取得しながらデータを生成します。
PDF版(英語)
はじめに
Matthew Hammer|アプリケーションサイエンティスト|Molecular Devices
ショーン・ニールセン・アルバラド博士|フィールドアプリケーションサイエンティスト|モレキュラーデバイス
1960年代に緑色蛍光タンパク質が発見されて以来、可視光全域に及ぶ多種多様な蛍光タンパク質(FP)とその変異体が開発されてきた。これらの遺伝子コード化された蛍光タンパク質は、セル生物学の分野に革命を巻き起こした。シアン蛍光タンパク質(CFP)は、FRETのようなマルチカラー応用における有用性から、大きな関心を集めている。これは、CFPの励起スペクトルとEmissionスペクトルが、ほとんど使用されない波長範囲にまたがっているため、様々な蛍光色素とのマルチプレックスに理想的だからである。
蛍光タンパク質技術と自動化顕微鏡の進歩は、研究者の遺伝子機能と生きたセル内の動的プロセスを研究する能力を拡大した。蛍光タンパク質は一般に、目的の遺伝子に融合したレポーター遺伝子として使用される。FPでタグ付けされた遺伝子産物が細胞でうまく発現されると、タンパク質、細胞小器官、細胞区画の機能を研究したり、局在を追跡したりするためにイメージングすることができる1。
FP融合産物を直接可視化することは、細胞内で新規遺伝物質を発現させる方法を最適化する上でも役立つ。トランスフェクションとトランスダクションは、核酸やタンパク質を細胞に導入するための2つの一般的な方法である。しかし、それぞれの方法は綿密な計画、最適化、時間を必要とし、遺伝物質をいかに効率よく細胞に導入し、発現させるかによって制限される。これらの要因から、トランスダクションやトランスフェクションの効率を評価するためには、ロバスト性で精密な方法を用いる必要がある。
このアプリケーションノートでは、ImageXpress® Pico自動細胞イメージングシステムとCellReporterXpress®画像取得・解析ソフトウェアの有用性を、導入効率の評価によるベクター濃度の最適化のために紹介します。遺伝子導入にBacMamベクターシステムを利用したCellLight™ Nucleus-CFP、BacMam導入試薬で2つの細胞株を一過性に導入した。ここでは、ImageXpress Picoの明視野およびCFPチャンネルを用いた画像取得と、CellReporterXpressソフトウェアを用いたロバスト性導入効率解析について述べる。次に、マルチカラーイメージングにおけるCFPチャンネルの有用性を強調する。
材料
- ImageXpress Pico自動細胞イメージングシステム(Molecular Devices社製)
- CellReporterXpress画像取得・解析ソフトウェア(Molecular Devices社製)
- HeLa細胞(ATCC、P/N:CCL-2)
- U2OS細胞(ATCC、P/N:HTB-96)
- 96ウェルマイクロプレート(Greiner, cat #: 655090)
- CellLight Nucleus-CFP BacMam 2.0 (ThermoFisher, cat #: C10616)
- MitoTracker Deep Red FM(サーモフィッシャー社、cat #: M22426)
- AlexaFluor 546 Phalloidin (ThermoFisher, cat #: A22283)
方法
BacMam導入試薬を用いたHeLaおよびU2OS細胞の導入
ImageXpress Picoシステムを用いてこの導入アッセイを実施するワークフローの概略を図1に示す。HeLa細胞とU2OS細胞を96ウェルの透明底マイクロプレートに1ウェル当たり8,000細胞ずつプレーティングした。細胞は37℃、5% CO2で一晩インキュベートした。その後、CellLight Nucleus- CFP, BacMam 2.0 (BacMam Nucleus-CFP)を4つの異なる粒子濃度でウェルに添加した:25、50、75、100粒子/細胞(PPC)。この試薬は、CFPに融合したSV40核局在化配列を封じ込めたBacMamコンストラクトからなる。各PPC濃度処理はトリプリケートで行い、細胞を導入試薬とともに37℃、5%CO2で19時間インキュベートした。イメージングに先立ち、培地とBacMam Nucleus-CFPをウェルから除去し、生細胞イメージング培地と交換した。

図1. ImageXpressPicoシステムとCellReporterXpressソフトウェアを用いたCellLight、BacMam導入効率アッセイのワークフロー。U2OSとHeLa細胞を、異なる細胞あたりの粒子(PPC)濃度のBacMam試薬とともに19時間インキュベートした。画像は10倍の対物レンズで撮影され、透過光細胞スコアリング解析モジュールがOn-the-flyで実行された。
ラベルフリーイメージングと蛍光イメージャー
ImageXpressピコシステムを用いて、明視野およびCFPチャンネルで10倍画像を撮影した。各チャンネルの露光時間は明視野で3ms、CFPで1000msであった。ウェルあたり9部位が撮影され、ウェルの47.52%が撮影された。取得設定は、コントラストを強調するために明視野画像をわずかにデフォーカスすることにより、明視野解析用に最適化された(図2および3)。
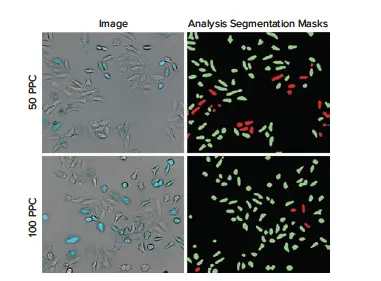
図2. CellLight Nucleus-CFP、BacMam添加19時間後のHeLa細胞の代表的な10倍像 (左)50 PPCまたは100 PPCで処理したウェルの画像。形質転換されたHeLa細胞(明視野およびシアン)は、形質転換されていない細胞(明視野のみ)と比較して明確に可視化できる。(右)CellReporterXpressソフトウェアのGeneralモジュールである透過光Cell Scoringを利用して、CFP発現に基づく形質導入の陽性細胞(緑)または陰性細胞をスコア化した。
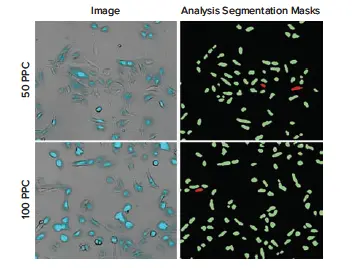
図3. CellLight Nucleus-CFP、BacMam添加19時間後のU2OS細胞の代表的な10倍像。 左)50PPCまたは100PPCで処理したウェルの画像。形質転換されたU2OS細胞(明視野とシアン)が明瞭に可視化されている。(右)CellReporterXpressソフトウェアのGeneral Moduleである透過光Cell Scoringを利用して、トランスダクション陽性(緑)または陰性(赤)の細胞をスコアリングした。
マルチカラー染色
細胞を4%パラホルムアルデヒドで固定する前に、MitoTracker Deep Redで30分間染色し、PBSで1回洗浄した。固定後、セルを洗浄、ブロック、透過処理し、AlexaFluor 546 Phalloidinで染色した。その後、細胞をPBSで2回洗浄してから、ImageXpress Picoシステムで対物レンズ40X、CFP、TRITC、Cy5チャンネルでイメージングした。
トランスダクション効率の自動画像解析
CellReporterXpressの透過光Cell Scoring, General解析モジュールは、HeLaとU2OS細胞のトランスダクション効率を解析するために、撮影中にOn-the-flyで実行された。最小限のユーザー介入で、解析モジュールは明視野チャネルを用いて細胞を定量し、CFP発現に対して陽性または陰性のスコアをつけるように設定された。図3に見られるように、明視野画像をわずかにデフォーカスすることで、解析に最適なコントラストが得られ、解析はコントラストの低い薄いU2OS細胞を正確にカウントすることができた。マルチパラメトリックリードアウトが解析から生成され、トランスダクション実験結果の包括的なビューを提供した(図4A)。これらの読み出し値には、個々の細胞測定値に加えて、陽性対陰性細胞数およびパーセント、全細胞および陽性細胞面積および強度のような要約測定値が含まれていた。
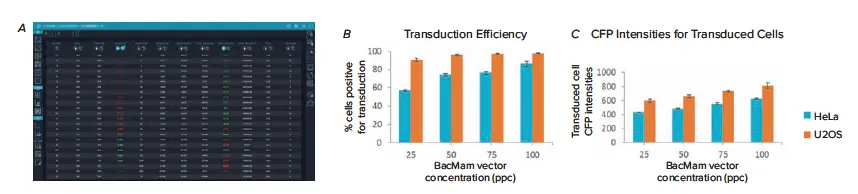
図4. 様々な濃度のセルライトNucleus-CFP、BacMamで処理したHeLa細胞とU2OS細胞のトランスダクション効率結果の比較。 (A) トランスダクション効率解析からマルチパラメトリックリードアウトが生成され、測定値はインタラクティブデータテーブルに表示された。ヒートマップは、陽性セル率(トランスダクション陽性)と陽性セル平均面積の測定値に適用され、データ表は陽性セル率測定値を用いてソートされた。このデータは、(B)導入陽性細胞の割合と(C)陽性細胞のCFP強度によって決定されるように、U2OSはHeLa細胞に比べてより容易に導入されることを示した。
結果
HeLa細胞とU2OS細胞における導入効率結果の比較
解析の結果、BacMam Nucleus-CFP PPC濃度の増加はトランスダクション効率の増加と相関し、U2OS細胞はこのBacMamシステムによるトランスダクションに対してより高い感受性を示した(図4)。トランスダクション効率の最も顕著な増加は、両方の細胞タイプで25と50のPPC処理の間に見られたが、この傾向はHeLa細胞でより顕著であった。HeLa細胞では、50PPC処理と75PPC処理で統計的に異なる結果は得られなかったが、100PPC処理ではHeLa細胞のトランスダクション効率が約10%上昇した。U2OS細胞に関しては、このトランスダクション効率の増加は、50、75、および100のPPC処理間で有意差はなかった(図4B)。各PPC濃度は、U2OS細胞において90%以上の導入効率をもたらした。
同様に、CFP-SV40核局在配列の全体的な発現は、PPC濃度の増加とともに増加した。これは、ポジティブに形質導入された細胞のCFP強度を測定することによって評価された(図4C)。個々の細胞データはまた、最高レベルのCFP強度を持つHeLaとU2OS細胞の特徴を同定するためにプローブされ、それは細胞面積が小さく、丸みを帯びた外観を持つ細胞であることが判明した(図5)。この丸みを帯びた細胞形態は分裂中の細胞の特徴であるが、これを確認するには生存率、増殖、細胞周期マーカーによる染色が必要であろう。
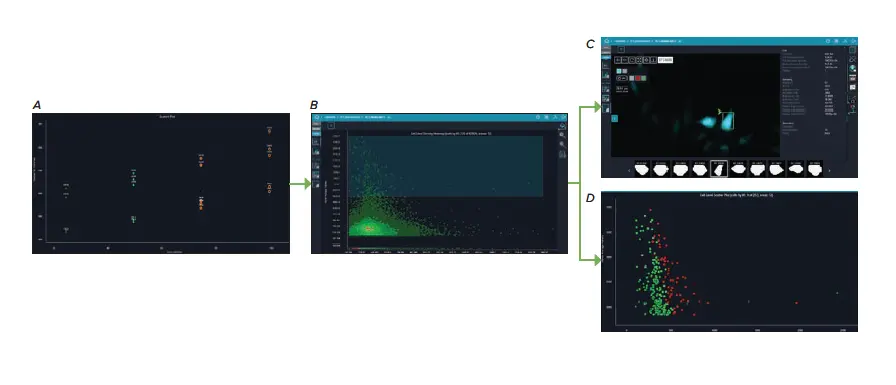
図5. CFP強度が最も高かったHeLa細胞とU2OS細胞のセルレベルデータ。(A) 75 PPC および 100 PPC 処置のウェルは、CFP 強度が最高レベルであったため、強調表示された。(B)細胞レベルの密度ヒートマップは、細胞面積とCFP強度の関係を表示し、各データ点は個々の細胞を表す。最高レベルのCFP強度を持つ細胞を選択し、(C)細胞イメージギャラリーおよび(D)細胞レベル散布図に表示した。セルレベル散布図のヒートマップターゲットはCFP積分強度である。
さらに、自動細胞顕微鏡によるCFP-SV40融合体の可視化により、この挿入キメラタンパク質の局在が明らかになった。CFP発現が増加すると、図5Cに見られるように、SV40タンパク質の細胞質局在が増加することに気づいた。このことは、最高の導入効率を得るための最適なPPC濃度、あるいは導入された遺伝物質の最適な発現と局在化のバランスが存在することを示している。これらの高い導入効率と固定後のCFPシグナルの持続性は、このBacMam試薬が生細胞イメージングとエンドポイントの固定細胞染色の両方の用途に有用であることをさらに実証した。さらに、CFPで標識された核をImageXpress Picoでイメージングする能力は、他の蛍光色素で染色された細胞構造をさらにイメージングするために、より一般的に使用される他のチャンネルを解放した(図6)。
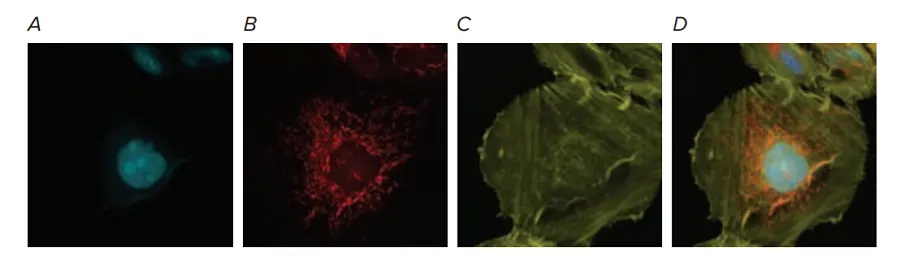
図6. U2OS細胞のマルチカラー染色により、追加蛍光色素とのマルチプレックスにおけるCFPチャンネルの有用性が浮き彫りになった。(A) BacMam Nucleus-CFP導入試薬75 PPC(核、シアン)で導入し、導入後に(B) MitoTracker Deep Red(ミトコンドリア、赤)と(C) AlexaFluor 546 Phalloidin(アクチン、黄)で染色したU2OS細胞の40倍画像。(D)3チャンネル(CFP、TRITC、Cy5)のオーバーレイをマージしたものをここに示す。
結論
BacMam試薬は、HeLaおよびU2OS細胞を効果的に形質導入し、生細胞イメージングアプリケーションにおいて、より一般的に使用される核染色に代わる適切な選択肢を提供する。核導入の評価と定量において、ImageXpress PicoシステムとCellReporterXpressソフトウェアの有用性を実証した。ロバスト性の高い集束メソッド、あらかじめ設定された解析モジュールとデータレポートにより、ImageXpress Picoシステムはトランスダクション/トランスフェクションアッセイプロトコルの評価と最適化に不可欠なツールとして機能した。さらに、CFPをイメージングする能力は、GFPのような通常使用される蛍光タンパク質の適切な代替手段を提供し、より一般的に使用される蛍光チャンネルを開いて、追加の細胞マーカーや構造の染色と可視化を可能にします。
リソース
- Haney SA, Bowman D, Chakravarty A. ハイコンテントスクリーニング入門。Wiley. 2015.
PDF版(英語)