Application Note HTSに適した迅速なアッセイで
ウイルス中和を評価
- ELISAワークフローによる迅速で簡単なアッセイセットアップ
- BSL-3やセル培養は不要
- プラーク減少中和試験のデータと一致した結果
PDF版(英語)
はじめに
Cathy Olsen, PhD | Sr. Applications Scientist | Molecular Devices
SARS-CoV-2ウイルスによるCOVID-19の世界的大流行により、このウイルスの病態を理解し、ワクチンを発見・開発するための多くの研究ツールの迅速な開発が必要となった。COVID-19の研究では、このウイルスによる感染やワクチン接種に対する免疫反応をモニターするためのアッセイが重要である。中和抗体は免疫応答とワクチン効果の重要なバイオマーカーであるため、患者血清検体中の中和抗体レベルは効率的にモニターできる重要なパラメーターである1。
ヒト血清中の中和抗体の同定は、プラーク還元中和(PRNT)アッセイのような従来の方法を用いて一般的に行われてきた。しかし、PRNTは生きた感染性ウイルスを標的セルに添加するため、BSL-3の実験室と手間のかかる細胞培養技術を必要とする。得られたデータの解析には時間がかかり、自動化には適さない。また、偽ウイルス中和試験 (pVNT) 法は、ウイルスを改変したものを使用して BSL-2 ラボで実施できますが、中和活性を測定するために細胞培養と蛍光イメージャーを必要とするため、サンプルのハイスループットスクリーニングには適していません2。
GenScript cPass™ SARS-CoV-2中和抗体検出キットは、従来のウイルス中和アッセイのハードルを克服するために開発された代替ウイルス中和試験(sVNT)である。図1に概略を、図2にグラフを示すように、酵素免疫吸着法(ELISA)形式を採用しています。
スパイクタンパク質の受容体結合ドメイン(RBD)のHRP標識フラグメントを、中和抗体を封じ込めた患者血清サンプルと混合する。この混合物を ACE2 受容体がプレーティングされた ELISA プレートに添加します。サンプル中の抗体が中和活性を持つ場合、HRP-RBDとACE2との結合が阻害され、その後の洗浄でHRP-RBDが除去されます。その結果、吸光マイクロプレートリーダーを用いて測定されるシグナルは、中和抗体が存在すると低くなり、アッセイ対照のシグナルと比較することで、被験試料に存在する中和活性を評価することができます3。
ここでは、SpectraMax® マイクロプレートリーダーで検出し、SoftMax® Proソフトウェアを使用して解析したsVNTキットの結果を示します。これらの結果は、従来のPVNT法を用いて得られた結果と密接な相関がある一方で、わずかな時間しか必要とせず、実験室のバイオセーフティレベルの制限もより緩やかである。

図1. PRNTとsVNTキットのワークフローの比較。sVNTアッセイはBSL-2ラボで1時間で完了しますが、PRNTは生きたSARS-CoV-2ウイルスと煩雑な細胞培養技術を必要とし、BSL-3ラボで2日以上かかります。
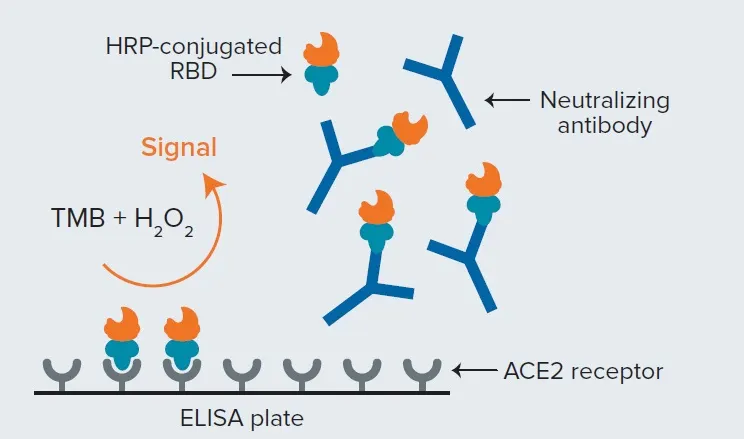
図2. SARS-CoV-2 sVNT法。このアッセイはELISA形式を採用しており、検査サンプル中の中和抗体によるACE2へのRBD結合の阻害を検出できる。
材料
- GenScript cPass™ SARS-CoV-2 中和抗体検出キット (GenScript cat. #L00847-A)
- PRNT(Corgenix 社)により中和活性陽性が確認された血清検体(10 検体)
- MultiWash+™ マイクロプレートウォッシャー(Molecular Devices社製)
- 吸光度検出モード付き Molecular Devices マイクロプレートリーダー:
⚪︎SpectraMax® ABS Plusマイクロプレートリーダー
⚪︎SpectraMax® iD5マルチモードマイクロプレートリーダー
⚪︎SpectraMax® i3x マルチモードマイクロプレートリーダー
⚪︎SpectraMax® M5e マルチモードマイクロプレートリーダー
測定方法
キットの全成分および検体は、アッセイセットアップ前に室温に戻しておきます。
希釈が必要なキット試薬は以下のように調製した:
- 20 倍希釈液を脱イオン水で希釈し、1 倍希釈液を調製した。
- HRP-RBD 原液を HRP 希釈用緩衝液で 1:1000 に希釈し、HRP-RBD 作用液とする。
被験試料とアッセイコントロールを HRP 標識 RBD と混合し、以下のようにインキュベートした。陽性および陰性コントロールとともに検体をサンプル緩衝液で1:10に希釈した(例:検体12μL+緩衝液108μL)。希釈した各検体およびコントロールは、等容量のHRP-RBD作業溶液と別々のチューブで混合した(例えば、120μLのHRP-RBD作業溶液+120μLの希釈した検体またはコントロール)。混合液を37℃で15分間インキュベートした。
100μLの陽性コントロール混合液、陰性コントロール混合液、およびサンプル混合液をアッセイストリップの重複ウェルに添加した。プレートを密封し、37℃で15分間インキュベートした。
MultiWash+プレート洗浄器を用いて、1ウェルあたり300μLの1X洗浄液で全ウェルを4回洗浄し、最後に十字方向に吸引した。その後、100μLのTMB溶液を各ウェルに添加し、プレートを密封して暗所、室温で15分間インキュベートした。
| カットオフ | 結果 | 解釈 |
|---|---|---|
| ≥ 30% | 陽性 | SARS-CoV-2中和抗体検出 |
| < 30% | 陰性 | SARS-CoV-2中和抗体検出せず |
表1. アッセイ結果の解釈に使用した阻害率のカットオフ値。
TMB基質でインキュベートした後、50μLの停止液を各ウェルに加え、各マイクロプレートリーダーで450nmの吸光度を直ちに読み取った。
試験結果の妥当性は、陰性コントロールのOD450値が1.0以上、陽性コントロールの値が0.3以下であるかどうかを判定することで評価した。これらの基準を満たさない場合、試験結果は無効となり、再現性が必要となる。
各試験サンプルの阻害率は、以下の式で算出した:
阻害率 = (1 - 試料のOD値/陰性コントロールのOD値) x 100
表1のカットオフ値は、検出可能なSARS-CoV-2中和抗体の有無を陽性または陰性と解釈するために使用した。表中のカットオフ値はSARS-CoV-2 sVNTキットのマニュアルによる。異なる地域や民族的背景の場合は、代表的な患者の血清パネルに基づいた独自のカットオフ値を設定するように指示されています。
結果
陰性コントロールと陽性コントロールを用いて、アッセイ結果の質を評価した。表2に示すように、陰性コントロールウェルのOD450値は1.0以上であり、陽性コントロールウェルのOD450値は0.3以下であった。
サンプルおよび陰性コントロールの OD450 値は、Methods に記載されているように、阻害率の算出に使用した。30%以上の阻害率はSARS-CoV-2中和抗体の存在を陽性と解釈し、30%未満は陰性と解釈した。PRNT法で中和活性が陰性と判定された3検体は、いずれもsVNT法でも陰性であった。同様に、PRNTで陽性と判定された10検体は、sVNTでも陽性と判定された(表3)。
| コントロール | OD450 | 平均 | 標準偏差 | %CV |
|---|---|---|---|---|
| 2.066 2.148 | 2.107 | 0.058 | 2.7 | |
| 0.063 0.061 | 0.062 | 0.002 | 2.8 |
表2. 陰性および陽性コントロールのOD450値は、それぞれ1.0以上および0.3以下であり、アッセイ結果の妥当性を示した。コントロールは二重に実施され、%CV値は3.0以下で再現性を示した。
|
プラークの減少 中和試験 |
GenScript sVNTアッセイ |
|||
|---|---|---|---|---|
| サンプル | PRNT90 |
平均OD 450 |
% 阻害率 |
結果 |
| N-1 | <20 | 1.991 | 5.5 | ネガティブ |
| N-2 | <10 | 1.869 | 11.3 | ネガティブ |
| N-3 | <20 | 1.590 | 24.6 | ネガティブ |
| P-1 | 160 | 0.112 | 94.7 | ポジティブ |
| P-2 | 80 | 0.061 | 97.1 | ポジティブ |
| P-3 | 80 | 0.096 | 95.4 | ポジティブ |
| P-4 | 160 | 0.091 | 95.7 | ポジティブ |
| P-5 | 320 | 0.084 | 96.0 | ポジティブ |
| P-6 | 320 | 0.141 | 93.3 | ポジティブ |
| P-7 | 160 | 0.105 | 95.0 | ポジティブ |
| P-8 | 640 | 0.101 | 95.2 | ポジティブ |
| P-9 | 640 | 0.149 | 92.9 | ポジティブ |
| P-10 | 160 | 0.225 | 89.3 | ポジティブ |
表3. プラーク減少中和試験(PRNT)による、前回陰性と判定された3検体および陽性と判定された10検体の阻害率および陽性対陰性の結果。結果はSpectraMax ABS Plusリーダーを使用したもので、他のSpectraMaxリーダーでも同じ結果(陽性対陰性)が得られました。
結論
GenScript cPass SARS-CoV-2 中和抗体検出キットは、患者血清検体を用いて得られたデータが、より伝統的で手間のかかる PRNT 法で得られた結果と一致した。sVNTキットは、使いやすい試薬とコンパクトなELISAワークフローを提供し、約1時間で完了することができた。1回必要な洗浄ステップは、貴重な時間を節約するためにMultiWash+プレートウォッシャーを使用して自動化された。SoftMax Proソフトウェアを搭載したSpectraMaxリーダーは、必要な計算を適用し、結果を自動的に出力するように設定された式を備えたアッセイ特異性プロトコルを使用して分析できるデータを生成する。
参考文献
- Lau EHY, Tsang OTY, Hui DSC, Kwan MYW, Chan W, Chiu SS, Ko RLW, Chan KH, Cheng SMS, Perera RAPM, Cowling BJ, Poon LLM, and Peiris M. SARS-CoV-2感染における中和抗体価。Nature Communications 12:63 (2021).
- COVID-19ワクチンBNT162b1はヒト抗体およびTH1 T細胞応答を誘発する。Nature 586, 594-599 (2020).
- SARS-CoV-2 surrogate Virus Neutralization Test (sVNT) Kit Manual (cat. #L00847).
PDF版(英語)