Application Note 自動タイムラプスイメージングによる血管新生の評価
- 生細胞タイムラプスイメージングによる経時的な血管新生ネットワーク形成の可視化
- あらかじめ設定された解析モジュールにより、血管新生の様々な段階を通してHUVEC細胞の定量的評価を実施。
- チューブの長さ、面積、分岐数、セグメント数、連結セット数など、血管新生ネットワークを評価するための複数のリードアウトを生成。
PDF版(英語)
はじめに
マシュー・ハマー|アプリケーションサイエンティスト|モレキュラー・デバイス
ジェイン・ヘスレー|Sr.アプリケーションサイエンティスト|モレキュラー・デバイス
既存の血管から新しい血管が形成される血管新生は、脊椎動物の発生と創傷治癒に関わる重要な生理的プロセスである。血管新生のプロセスは、血管新生促進分子と血管新生抑制分子の作用によって制御され、厳密な恒常性制御下にある。この恒常性の破綻は、様々な病態に関与していることが示されている1。血管新生過程における不全や血管の保存不全は、心筋梗塞のような様々な虚血性疾患や神経変性疾患に関与している4。血管増殖の異常な増加や異常な血管形態は、癌、慢性炎症、黄斑変性症のような多くの疾患と関連している1,3-5。
血管新生を研究するための様々な細胞ベースアッセイを開発することは、血管新生促進化合物や抗血管新生化合物の効果と同様に、癌、心臓虚血、その他の疾患の治療薬を開発するために極めて重要である。血管新生を評価するためにはイメージング法が重要であり、この複雑な生物学を適切に捉え、解析し、定量化するためには、ロバスト性で精密なイメージングシステムとソフトウェアの使用が不可欠である。
我々は、正常ヒト真皮線維芽細胞とSartorius社(IncuCyte® Angiogenesis 96-well PrimeKit) のGFPを発現するレンチウイルス感染ヒト臍帯静脈内皮細胞(HUVEC)を含む共培養血管新生モデルを用いて、経時的な血管新生の定量的評価におけるImageXpress® Pico自動細胞イメージングシステムの有用性を実証した。HUVECの血管新生チューブ形成に対する血管新生促進化合物および抗血管新生化合物の用量依存的効果を経時的に評価するために、不連続的な生細胞タイムラプスイメージングを行った。複雑なチューブネットワークを評価するために、自動画像解析を行い、複数のリードアウトを作成した。
材料
- IncuCyte Angiogenesis 96-well PrimeKit(Sartorius, cat.#4452)封入:
◦正常ヒト真皮線維芽細胞(NHDF)セル
◦CytoLight Greenを発現するヒト臍帯静脈内皮細胞(HUVEC CytoLight Green)
◦培地サプリメント - IncuCyte Angiogenesis PrimeKit VEGF/Suramin サプリメントキット(Sartorius、cat. #4437)
- 黒壁透明底96ウェルマイクロプレート(Greiner、cat. #655090)
- ラパマイシン(Thermo Fisher Scientific、cat. #PHZ1235)
- ImageXpress Pico 自動細胞イメージングシステムおよび CellReporterXpress® 自動画像取得・解析ソフトウェア
方法
血管新生PrimeKitアッセイ
正常ヒト真皮線維芽細胞とGFP発現正常ヒト臍帯静脈内皮細胞は血管新生PrimeKitで提供された 正常ヒト真皮線維芽細胞(NHDFs)を解凍し、製造業者のプロトコールに従って播種培地で再構成した。再構成後、NHDFを封じ込めたコニカルチューブを200 x gで4分間遠心分離してセルを沈殿させた。上清を除去し、NHDF細胞ペレットを12mLの完全播種培地に懸濁した。このNHDF細胞懸濁液100μLを黒壁透明底96ウェルマイクロプレートの各ウェルに播種した。プレートをフード内で室温で1時間インキュベートし、セルを落ち着かせた。GFP発現ヒト臍帯静脈内皮細胞(GFP-HUVEC)をNHDF層の上に1ウェルあたり100μL播種した。プレートをフード内でさらに1時間インキュベートし、HUVECを沈降させた。その後、ImageXpress Picoシステムで0日目の読み取りを行う前に、プレートを37℃のインキュベーターにさらに4時間置いた。
翌日、各ウェルから播種培地を除去し、150μLの増殖培地をウェルに添加した。最初の化合物添加は2日目に行い、その後の化合物添加は4日目と7日目に行った。化合物溶液は、加温した完全アッセイ培地で調製した。血管内皮増殖因子(VEGF)は、HUVEC細胞の血管新生を刺激するために利用した。VEGFワーキング溶液は、16ng/mLから0.25ng/mLまで、1:4希釈系列で4回に分けて調製した。既知の抗血管新生化合物の阻害効果を調べるために、VEGFの存在下でスラミンまたはラパマイシンをウェルに添加した。suraminとrapamycinの2倍作業溶液をVEGFの2倍溶液と組み合わせてウェルに添加した。VEGFの最終濃度は各ウェルで4 ng/mLであったが、血管新生阻害剤処理は1:4希釈で4重反復した。阻害剤の最終1倍濃度は、スラミンでは80μMから1.25μMまで、ラパマイシンでは1.2nMから0.018nMまでであった。
自動生細胞イメージング
生細胞イメージングには、5% CO2、20% O2、85%湿度、37℃温度を維持・監視する環境制御を統合したImageXpress Picoシステムを用いた。不連続的なタイムラプス取得が行われ、プレートはImageXpress Picoシステムで画像化された後、次の画像化時点までインキュベーターに戻された。最初の時点はプレーティング後1時間で取得した。2回目の時点はプレーティングから12時間後に撮影し、3回目の時点はプレーティングから24時間後に撮影した。その後9日間、24時間ごとに1回プレートを撮像した。
10倍の対物レンズで1ウェルあたり9カ所を明視野とFITCチャンネルで撮影し、各ウェルの◎~◎35%を効率よくイメージングした。画像はStitched Acquisition Protocolを用いて、手動で設定することなくその場でつなぎ合わせた。FITCチャンネル画像もオンザフライ2Dデコンボリューションで、露光時間200msで取得した。明視野画像の露光時間は10msであった。
自動画像解析
CellReporterXpressソフトウエアにあらかじめ設定されているAngiogenesis Skeletonization解析モジュールを利用して、血管新生ネットワークの発達を同定・測定した。最小限のユーザー入力で、解析モジュールは分裂、成長、チューブ形成を通してHUVEC細胞を正確にセグメント化した。解析設定は、最小幅4μmの細長い対物をチューブとして同定するように最適化された(図1および2)。この最小幅の区分けにより、小さなセル、チューブを形成しない事象、および残骸が解析でピッキングされないことが保証された。HUVECの細胞分裂と成長を示す細胞の大きな塊は、ノードとして同定された(図1D)。さらに、血管新生促進化合物および抗血管新生化合物の効果を効果的に評価する定量的測定が行われ、平均チューブ長および総チューブ面積、1セットあたりのチューブ長、ノード数、セグメント数、分岐点数が含まれた。本アプリケーションノートでは、HUVEC細胞のチューブ形成に対するVEGFおよび血管新生阻害化合物の効果を説明するために、1セットあたりのチューブ長の測定値を示す(図2および3)。
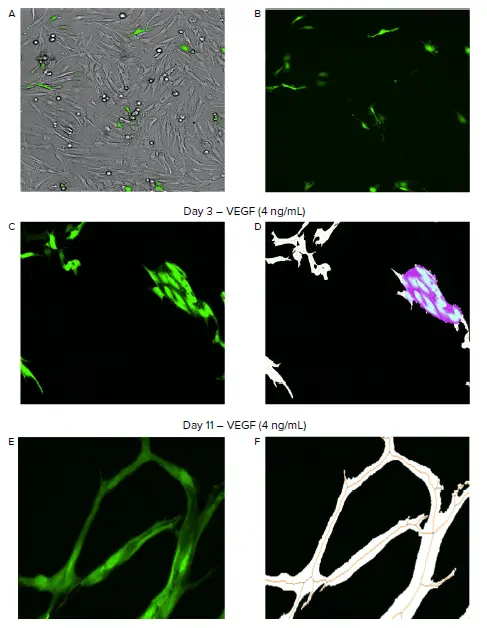
図1. ImageXpress Picoシステムによる血管新生の自動イメージングと解析。A-B。線維芽細胞とHUVEC細胞の共培養を可視化するために明視野でイメージングし、GFP発現HUVEC(緑)をイメージングするためにFITCチャンネルを利用した。C-F。CellReporterXpressソフトウェアの血管新生骨格形成解析モジュールは、タイムラプス実験を通してチューブネットワーク形成を同定し測定した。解析モジュールは、血管新生チューブ(白)、チューブネットワークの骨格(オレンジ)、分岐点(青)、ノードとしての分裂・成長細胞の塊(紫)を同定・計測した(D, F)。
結果
VEGFによる血管新生の刺激
血管新生促進因子の効果をモニターする能力は、虚血性疾患と闘うための薬剤の開発だけでなく、発生や創傷治癒における血管新生の重要性を理解するためにも重要である。主要な成長因子を含む基本的なシグナリング分子は、血管網の発達とパターニングを制御している2,3。内皮細胞にとって重要な血管新生促進成長因子として知られるVEGFによる血管新生の刺激を、このライブセルin vitroアッセイで行った。HUVEC細胞はベースラインレベルのチューブのアウトグロースと形成を示し、VEGF添加後直ちに反応が見られた。チューブの長さは、2日目の成長因子の添加後とその後の各添加後に顕著に急増した(図3)。しかし、VEGFの最高濃度である16 ng/mLでは、7日目の添加後の1セットあたりのチューブ長の増加はごくわずかであった。16ng/mLと4ng/mLのVEGFはともに管網形成の最大刺激を示したが、2つの低濃度ではそれぞれ60%と40%の刺激であった。
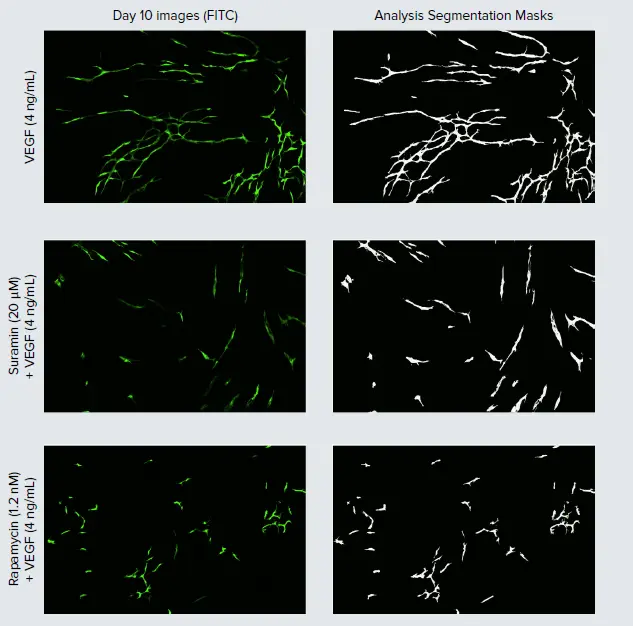
図2. 血管新生チューブネットワーク形成の刺激と抑制。HUVEC細胞の代表的な10日目の画像(左)と、それに対応する画像解析によるチューブネットワーク(白)のセグメンテーションマスク(右)。VEGF刺激によるネットワーク形成に対する阻害化合物の効果を調べるために、2、4、7日目に4ng/mLのVEGF存在下でスラミンとラパマイシン処理を加えた。
スラミンとラパマイシンによる血管新生の阻害
血管新生阻害は、様々な癌、炎症性疾患、変性疾患を含む様々な疾患に対する治療開発の焦点となっており、現在、いくつかの抗VEGF治療薬が特定の癌や加齢黄斑変性症の治療薬として上市されている3。VEGFが介在する血管新生の阻害を示すために、われわれは4ng/mLのVEGFを加えながら、2種類の間接的血管新生阻害剤、一般的なチロシンキナーゼ阻害剤であるスラミンとmTOR阻害剤であるラパマイシンを様々な濃度で試験した。スラミンとラパマイシンはともにHUVECのチューブ形成に悪影響を与え、4ng/mLのVEGFコントロールと比較してチューブの長さが短くなった(図2および3)。血管新生の阻害は明らかに用量依存的であった。試験した化合物の濃度は、4 ng/mL VEGFコントロールと比較して、これらの処理群の細胞の1セットあたりのチューブ長が小さいことからわかるように、すべてHUVEC細胞が最大刺激に達するのを妨げた。阻害効果のピークは、最高濃度の80μMのスラミンでみられ、この濃度では、タイムラプス実験中に管長が正味で減少した。
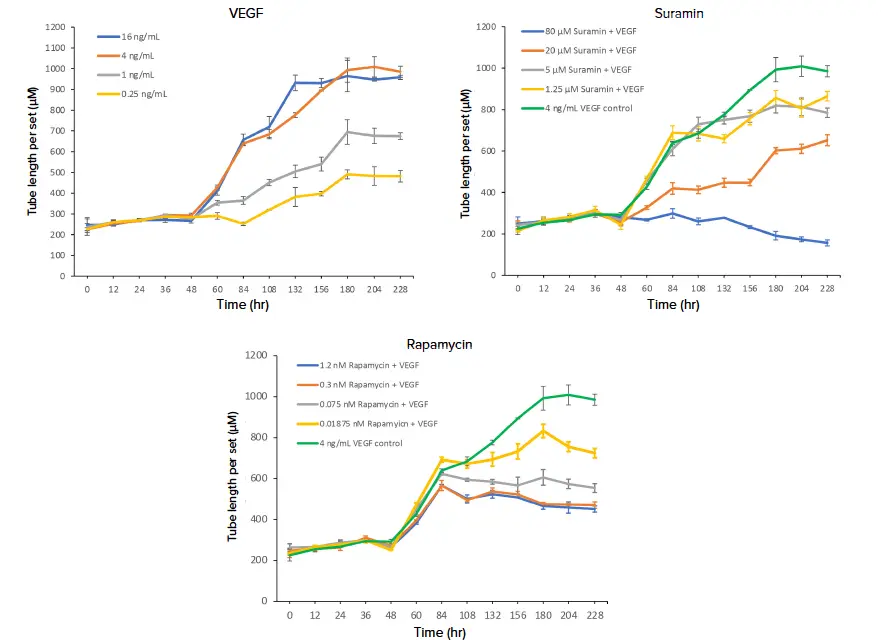
図3. 血管新生チューブネットワーク形成の評価のためのチューブ長測定。CellReporterXpressソフトウェアのAngiogenesis Skeletonization解析モジュールから生成された1セットあたりのチューブ長(チューブ長をミクロン単位で連結セット数で割ったもの)を用いて、血管新生促進因子VEGF(A)、抗血管新生化合物スラミン(B)およびラパマイシン(C)の濃度増加の効果を評価した。スラミンとラパマイシンは4ng/mLのVEGF存在下でウェルに添加し、これらの化合物の効果を4ng/mLのVEGFコントロールと比較した。様々な濃度の処理を4回反復し、反復のデータポイントを平均した。
結論
血管新生の臨床的、生物学的意義は、この複雑でダイナミックなプロセスの研究におけるin vitro細胞ベースアッセイの重要性を強調している。ここで示されたデータは、ImageXpress Picoシステムが、最適なライブセル環境条件を維持しながら、血管新生促進化合物および阻害化合物の効果を正確に捕捉できることを実証した。ロバスト性の解析手法により、血管新生ネットワークの特徴づけと定量化が可能となり、血管新生に対する新規治療薬の効果を研究するために利用することができる。
参考文献
- Li, Tinglu et al. "Tumor angiogenesis and anti-angiogenic gene therapy for cancer.". オンコロジー・レターズ16,1巻(2018年): 687-702. doi:10.3892/ol.2018.8733
- 松本 健、江間 正嗣. "発生、再生、腫瘍におけるVEGF-Aシグナルの役割". 生化学ジャーナル, 第156巻, 第1号, 2014年7月, 1-10ページ, https://doi.org/10.1093/jb/mvu031
- Melincovici, Carmen Stanca et al. "Vascular endothelial growth factor (VEGF) - key factor in normal and pathological angiogenesis.".
ルーマニア形態学・発生学ジャーナル = Revue roumaine de morphologie et embryologie 59,2巻 (2018): 455-467. - 守屋純司、南野徹. "血管新生、がん、血管の老化". 心血管医学のフロンティア 4巻 65. 24
Oct. 2017, doi:10.3389/fcvm.2017.00065 - Nowak-Sliwinska, Patrycja et al. "Consensus guidelines for the use and interpretation of angiogenesis assays.". 血管新生
vol. 21,3 (2018): 425–532. doi:10.1007/s10456-018-9613-x
PDF版(英語)