Application Note 人工多能性幹細胞をベースとした神経突起伸長アッセイを用いた
神経毒性および神経細胞発達の評価
- iPSC由来ニューロンを用いた神経毒性作用の同定
- マルチパラメーター画像解析を用いた複雑な神経突起ネットワークの定量化
- 神経毒性の可能性について化学物質を評価し、優先順位をつける
PDF版(英語)
はじめに
オクサナ・シレンコ博士|シニアリサーチサイエンティスト|モレキュラーデバイス|カリフォルニア州サニーベール
環境中に未検査の化学物質が蔓延することへの懸念が高まり、ヒトの健康、特に神経発達に影響を及ぼす可能性のある化学物質を同定するための、信頼性が高く効率的なスクリーニングツールの開発が急務となっている。
われわれは、発達中の神経系に悪影響を及ぼす可能性のある化合物を選別し、その活性を評価するためのスクリーニングとして、神経突起伸長アッセイを評価した。このアッセイは、神経細胞が神経突起を伸ばして完全な神経ネットワークを形成するという、神経系の発達における重要なプロセスのモデルとして関連性が高いことから選択された2。このプロセスが阻害されると、ヒトやげっ歯類に悪影響が出る可能性があり、未熟神経突起、発達神経突起、成熟神経突起が化学毒性の標的となることが研究で示唆されている3。
神経突起伸長アッセイは主に発達期の神経毒性の評価に用いられるが、神経突起の退縮によって測定される神経変性の評価にも用いることができる。さらに、このアッセイは成体神経細胞における神経可塑性の評価にも関連するかもしれない4。スクリーニングアッセイでは、一般的に神経突起伸長が最も一般的な指標として報告されている1,5。自動イメージングを利用することで、化合物が神経突起伸長を阻害するさまざまなモードを網羅するために、総分岐数や総過程数などの追加的な特徴をマルチパラメーターで評価することが可能になる6,7。
材料
- ImageXpress®ナノ自動イメージングシステムとCellReporterXpress®ソフトウェア(Molecular Devices社製
- iCell ® Neurons (Cellular Dynamics International)
- ポリ-d-リジンプレコート384ウェルプレート(コーニングライフサイエンス社製)
- ラミニン(シグマ・アルドリッチ)
- パラホルムアルデヒド(Sigma-Aldrich)
- ウシ胎児血清 (シグマアルドリッチ)
- βチューブリンIII (TUJ-1) (BD Biosciences)
- Hoescht (サーモフィッシャーサイエンティフィック)
- 抗ß-チューブリン抗体(BD Biosciences)
- カルセインAM(サーモフィッシャーサイエンティフィック
iPSCを用いた神経突起伸長アッセイによる神経毒性化合物の同定
ヒトiPSC由来ニューロン(iCell Neurons)は、GABA作動性ニューロンとグルタミン酸作動性ニューロンの混合物で構成され、培地はCellular Dynamics International (CDI)から提供された。これらの研究で使用されたニューロンは、ニューロンマーカーであるβ-IIIチューブリンとMAP28に陽性の神経突起ネットワークを形成する、完全に分化・精製された細胞集団としてメーカーから提供された。セルは冷凍で受け取り、その後CDIが推奨するプロトコールに従って解凍、プレーティングした。細胞をポリ-d-リジン、プレコート384ウェルプレートにプレーティングし、3.3μg/mLのラミニンで処理した。化合物処理の前に、1ウェルあたり7,500個のセルをプレーティングし、iCell Neurons Maintenance Mediumで48時間維持した。これらのセルにおける神経突起ネットワークは通常、プレーティング後24時間で形成され始め、培養10~12日まで複雑さを増す。プレーティング後48時間で、神経突起伸長を評価したが、神経突起退縮も同時に生じている可能性がある。化合物は6段階の濃度範囲(0.3、1.0、3.0、10.0、30.0、100μM)で二重に試験した。各プレートには複数のDMSOコントロール(n=16)と未処理コントロール(n=16)が含まれた。0.3%までのDMSOを用い、アッセイ内での溶媒効果を評価した。セルは37℃、5% CO2で72時間化合物に暴露された。
次に培地を除去し、細胞を4%パラホルムアルデヒドで2時間固定した。続いて、1%ウシ胎児血清を加えたPBS中0.01%サポニンで透過処理した。次に、細胞をβ-チューブリンIII(TUJ-1)に対するAF488標識マウス抗ヒト抗体(1:100希釈)および2μg/mL Hoechstで3時間インキュベートした。β-チューブリンは神経突起伸長のマーカーとして、また無傷の神経細胞体のカウントにも用いた。インキュベーション後、染色液をリン酸緩衝生理食塩水(PBS)に交換した。あるいは、Calcein AMとHoechst色素(それぞれ0.5μMと2μM)で30分間染色した生細胞を用いて、神経毒性アッセイを行うこともできる。プレーティング密度の最適化および384ウェルフォーマットアッセイのプロトコールに関する詳細は、Sirenkoら6.
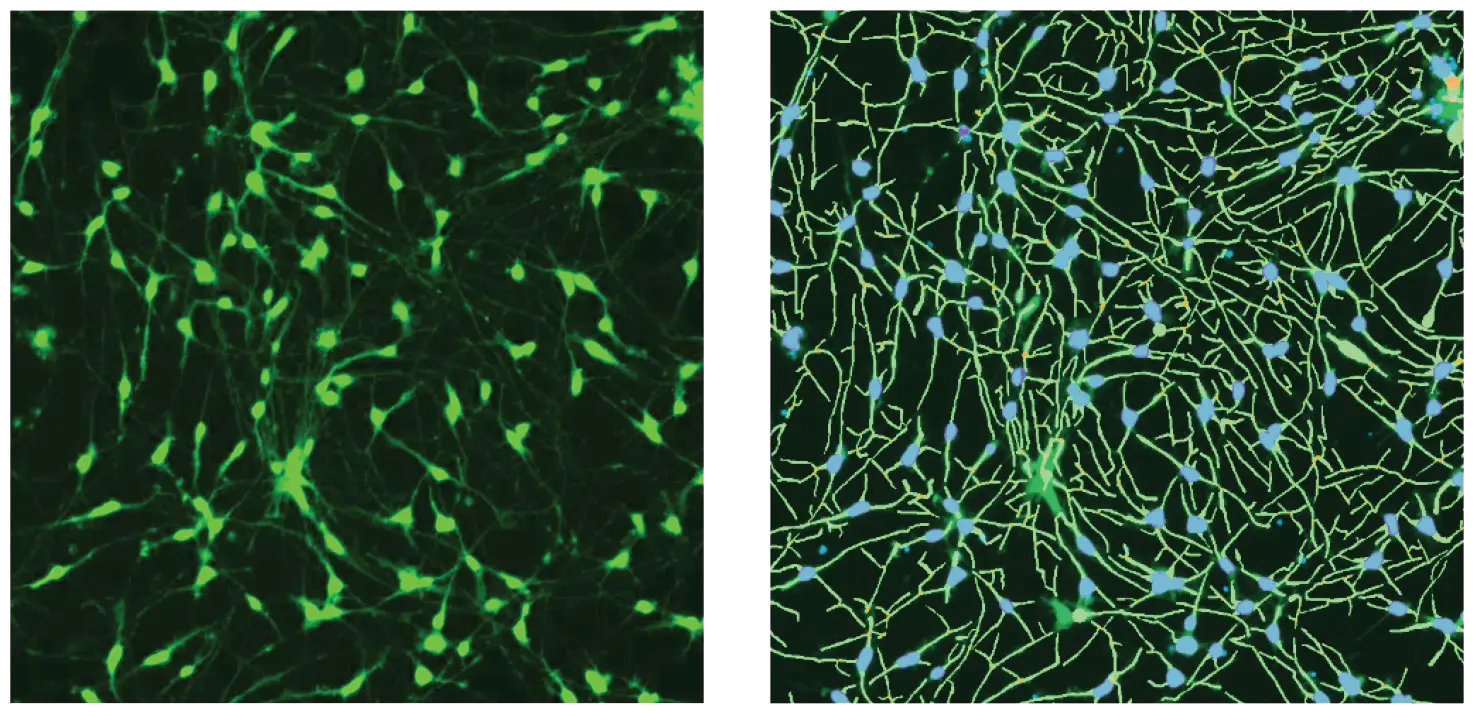
***図1. β-チューブリン(緑)染色のイメージングと対照細胞のソフトウェア解析のトレース。
iCell Neuronsを5日間プレーティングした後、固定し、AF488標識抗ß-チューブリン(TUJ-1)抗体(1:100)で染色した。画像はImageXpress Nanoシステムで10X Plan Fluor対物レンズとFITCチャンネルを用いて撮影した。画像はCellReporterXpressソフトウェアの神経突起トレーシング解析アルゴリズムを用いて処理した。右の解析マスクはアウトグロース(緑)と細胞体(青色)を示す。
個々のウェルの画像はImageXpress Nano自動イメージングシステムで10X Plan Fluor対物レンズを用いて取得した。384ウェルプレートの1ウェル当たり1つの部位で1枚の10X画像をキャプチャした。10X対物レンズは、ウェル総面積の約1/4を占める比較的多数の細胞(500~1,000個)/画像の神経突起ネットワークと細胞内構造を識別するのに十分な解像度を提供した。画像の取り込み後、すべての画像解析は、神経突起伸長と生存率評価のための画像処理アプリケーションモジュールを封じ込めたCellReporterXpressSoftwareを用いて行った。画像処理の例として、図1に神経突起画像の代表的な拡大画像と対応する解析マスクを示す。図2は、DMSO処理した神経細胞と化合物処理した神経細胞の画像と、ソフトウェアによるトレースオーバーレイを示す。
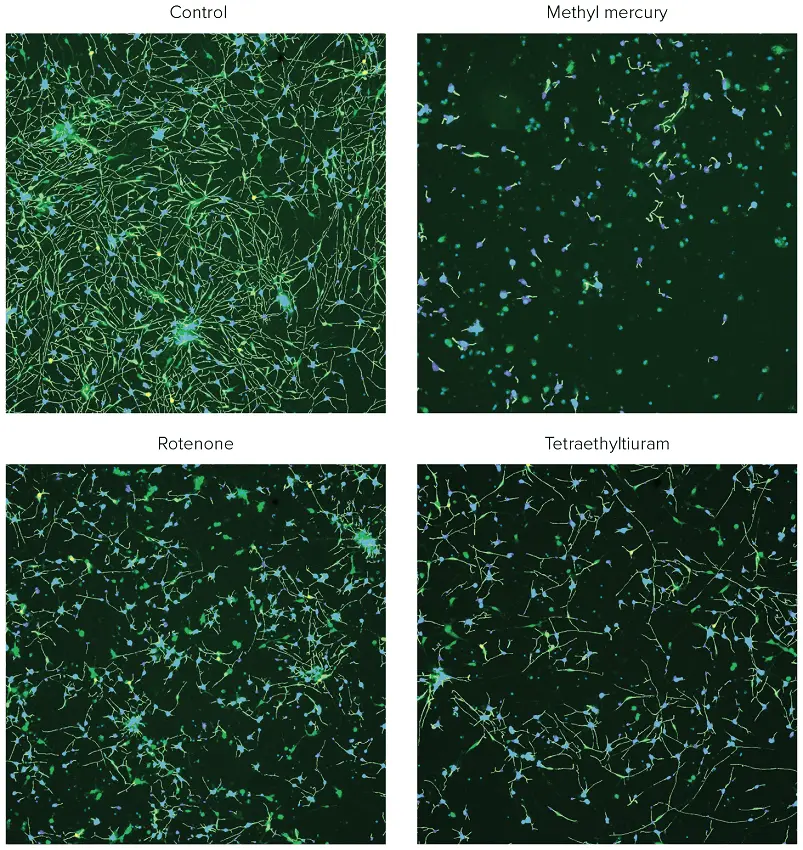
***図2. ß-チューブリン(緑)とHoechst(青)の合成イメージング。コントロール細胞と選択した化合物で処理した細胞の分析トレースを示す。
iCell Neuronsを48時間プレーティングし、化合物で72時間処理した後、固定し、Hoechst(2μM)とAF488結合抗TUJ-1抗体(1:100)の組み合わせで染色した。画像はImageXpress Nanoシステムで10X Plan Fluor対物レンズとDAPIおよびFITCチャンネルを用いて撮影した。画像はCellReporterXpressソフトウェアの神経突起トレーシング解析アルゴリズムを用いて処理した。標記化合物で処理した神経細胞では、神経突起ネットワークの破壊と細胞死が観察された。
マルチパラメーター画像解析を用いた神経突起ネットワークの複雑性の定量化
化合物処理効果による神経細胞ネットワーク形成の用量依存的阻害が観察された(図3)。これらの実験で撮影された画像の定量的解析では、培養神経細胞の形態学的特徴と、神経細胞ネットワークの程度と複雑さの両方を評価できる複数のパラメーターを導出した。具体的には、神経突起伸長は、アウトグロースの程度(例えば、全アウトグロースの長さや細胞あたりの平均アウトグロース)、神経突起の数(例えば、全神経突起数や細胞あたりの平均神経突起数)、枝分かれの程度(例えば、全枝数や細胞あたりの平均枝数)によって特徴付けられた。セルプレーティングと神経突起伸長は実験を通して一様であったため、統計解析には画像あたりの特徴(枝と突起)の総数を用いた。さらに、化合物による細胞死を評価するために、各画像中のß-チューブリン(TUJ-1陽性)、またはカルセインAM陽性の細胞体の数を定量した。細胞あたりのアウトグロースの長さ、個々の細胞あたりの突起と枝の数も測定したが、冗長なため統計解析には用いなかった。
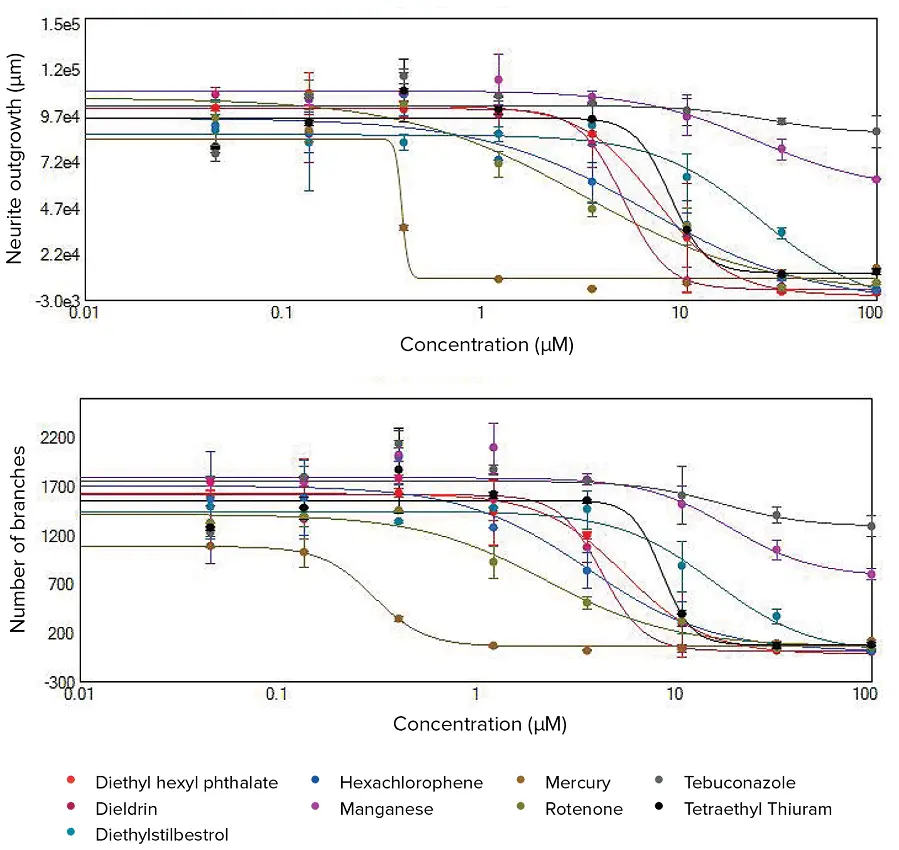
***図3. 神経突起伸長の長さと分岐の総数に対する濃度応答曲線。
化合物処理後に観察された神経突起ネットワークの破壊と細胞死は、CellReporterXpressソフトウェアの神経突起伸長解析アルゴリズムを用いて定量した。用量依存的効果は、アウトグロースの長さと枝の数の減少によって示される。これら2つの測定値を用いて、選択した化合物の4パラメータカーブフィットをここに示す。EC50値は表1に示した。
化合物の毒性作用は、EC50値(神経突起伸長を50%阻害する化合物の濃度)で比較することができる。EC50値は、神経突起伸長、分岐数、突起数、および生存細胞体数の値による4パラメータカーブフィット処理から導出した。図3は、神経突起ネットワークの全長(アウトグロースの全長)と枝の総数に関する濃度依存曲線を示している。これらの測定により、有効毒性濃度を定義し、潜在的な神経毒性作用について化合物を比較し、さらなる毒性評価の優先順位を決定することができた。
複数のパラメーターの用量反応評価
濃度応答曲線をHillモデルを用いて評価し、EC50濃度値を導出した。様々な読み出しに対するEC50値を表1に示す。試験した16種類の化合物のうち、11種類の化合物で処理すると、神経突起伸長が減少し、枝や突起の数も減少した。これら11種類の化合物のうち、6種類の化合物で処理すると、セルボディの数も減少した。他の5つの化合物は比較的影響が軽微であったため、EC50値は決定されなかった。全分岐と全アウトグロースのエンドポイント阻害のEC50値は高い一致を示した。神経細胞ネットワークの破壊は、選択された処理における細胞毒性効果に対して、より低濃度で明らかであった。したがって、細胞体数の減少について測定されたEC50値は、これらの化合物による処理による神経突起伸長阻害のEC50値よりも一般的に高かった。
| 化合物 EC50値 (µM) | 総アウトグロース | 枝 | プロセス | セル本体 |
|---|---|---|---|---|
| メチル塩化メチル | 0.403** | 0.307±0.029 | 0.569±0.183 | 1.19 |
| ロテノン | 3.31±1.56 | 2.28±0.616 | 9.77±6.94 | 11.5 |
| ディルドリン | 5.31±1.19 | 4.38±1.05 | 6.53±2.33 | 10.4 |
| ヘキサクロロフェン | 7.08±3.84 | 3.72±1.46 | 19.2±11.9 | 32.6±21.8 |
| フタル酸ジ(2-エチルヘキシル) | 7.79±0.63 | 5.72±0.73 | 9.48±0.49 | 12.6±1.07 |
| テトラエチルチラムジスルフィド | 9.133±4.28 | 8.82±7.94 | 13.2±5.92 | 12.3±5.08 |
| カルバリル | 15.5±30.4 | 2.5±0.673 | >100 | 102 |
| マンガントリカルボニル | 24.9±12.6 | 19.38±17.7 | 13.2±5.92 | >100 |
| ジエチルベストロール | 26.5±7.73 | 16.2±3.54 | 13.2±5.92 | >100 |
| テブコナゾール | 27.7±82.5 | 17.7±35.3 | 22.5±151 | >100 |
| クライゼン | 31.6±8.28 | 23.5±30.9 | >100 | >100 |
| アルジカルブ | >100*** | >100 | >100 | 影響なし |
| アセナフチレン | >100 | >100 | >100 | 影響なし |
| リン酸トリフェニル | >100 | >100 | >100 | >100 |
| ジアゼパム | >100 | >100 | >100 | 影響なし |
| ジベンズ(a,c)アントラセン | >100 | >100 | >100 | 影響なし |
* 神経突起伸長の長さと分岐の数を読み取り値として、試験化合物について測定したEC50値(μM)。誤差限界は、カーブフィット処理から定義されたパラメータ推定値の標準誤差である。** いくつかのパラメーターの標準誤差が未定義なのは、カーブフィット処理は収束したものの、パラメーター推定値の不確実性が決定できなかったことを示している。*** 100以上」は、試験した最高濃度(100 µM)で毒性作用(神経突起伸長、分枝数の減少など)が観察されたが、EC50値は決定されなかったことを意味する。**** 影響なし」は、試験した最高濃度(100 µM)で明らかな影響が観察されなかったことを意味する。***表 1. 濃度反応曲線は、全神経突起伸長、全枝、全過程、全セル体について計算した。EC50値は、Hillモデルを用いた各化合物処理の4パラメータカーブフィット処理から導き出した。
結論
神経突起伸長アッセイは、大規模な化合物ライブラリーの神経毒性を評価するのに適した、効率的で効果的なハイスループットスクリーニング実験である。このスクリーニングにより、ヒトにおいて神経毒性を誘発する可能性のある化合物の迅速な同定、評価、優先順位付けが可能となる。このアッセイは、神経細胞の発達に神経保護効果や刺激効果をもたらす可能性のある化合物の評価にも使用できます。ImageXpress ナノシステムは、ハイスループットスクリーニングキャンペーンに適した高度な表現型アッセイを実施するための効率的なツールです。
参考文献
- Radio, N.M., Breier, J.M., Reif, D.M., Judson, R.S., Martin, M., Houck, K.A., et al., 2015. ToxCast フェーズ 1 ライブラリーにおける環境化学物質のスクリーニングに、増殖と神経突起伸長の神経モデルを使用。Appl. * In Vitro Toxicol.*1 (2), 131-139.
- Harrill, J.A., Robinette, B.L., Freudenrich, T., Mundy, W.R., 2013. Neurotoxicology 34, 61-73. ラット大脳皮質一次ニューロンの神経突起亜集団に対する化学物質の影響を検出するためのハイコンテントイメージ分析の使用。
- Radio, N.M., Mundy, W.R., 2008. 神経突起伸長に対する化学物質の影響を評価するためのモデル。Neurotoxicology 29, 361-376.
- Lee W-CA, Huang H, Feng G, Sanes JR, Brown EN, So PT, et al. 2006. 成体視覚野のGABA作動性介在ニューロンにおける樹状突起の動的リモデリング。*PLoS Biol.*4(2): e29.
- Stiegler, N.V., Krug, A.K., Matt, F., Leist, M., 2011. 高密度培養におけるマルチパラメトリック生細胞イメージングによる、化学物質によるヒト神経突起伸長障害の評価。*Toxicol. Sci.*121, 73-87.
- Sirenko, O., Hesley, J., Rusyn, I., Cromwell, E.F., 2014. ヒトipsc由来神経細胞培養の生存率と形態を特性化するためのハイコンテントハイスループットアッセイ。*Assay Drug Dev. Technol.*12, 536-547.
- Ryan, K.R., Sirenko, O., Parham, F., Hsieh, J.H., Cromwell, E.F., Tice, R.R., Behl, M., 2016. 発生神経毒性または神経毒性のハイスループットスクリーニングとしてのヒト人工多能性幹細胞由来ニューロンにおける神経突起伸長。*Neurotoxicology.*53: 271-81.
- iCell Neurons|Cellular Dynamics. (n.d.). 2017年6月1日、http://www.cellulardynamics.com/products/neurons.html から取得
PDF版(英語)