Application Note ハイドロゲルを用いた細胞モデルの自動分注、
モニタリング、アッセイ開発
- 3D細胞モデルの開発、維持、画像化のためのワークフローを統合する。
- ユーザーフレンドリーでcGMP認証済みのインターフェースにより、BioAssemblyBot® 400とImageXpress®イメージャの統合と操作が容易。
- ハイスループット測定用3D細胞モデルのための、温度に依存しないゼノフリーマトリックス
- 自動化されたBAB400とImageXpress® マイクロコンフォーカルハイコンテントイメージングシステム(IXM-C)を使用して、3D細胞モデルのハイスループット、ハイコンテントイメージャーを改善します。
PDF版(英語)
はじめに
Prathyushakrishna Macha, PhD | Research Scientist | Molecular Devices
様々な微小環境をより正確に表現する3D細胞モデルは、正確な薬剤スクリーニングや疾患モデリングにとって非常に重要である。これらはin vitroやin vivoのモデルとして使用することができ、生物学的に適切な治療法の発見に不可欠なハイスループットでコスト効率の高いアッセイを実施することができます。創薬研究とスクリーニングに3Dモデルをより広く採用し、高輝度プロセスをよりシンプルにするために、コストと市場投入までの時間を大幅に削減するハイスループットスクリーニングと自動処理の必要性が高まっています。
アドバンスト・ソリューションズのバイオアセンブリーボット400(BAB400)は、複雑な生物モデルの構築に使用できるcGMP認定のマルチツールです。モデル構築に使用できる多目的プラットフォームで、空気圧分注と3Dプリンティング機能により、さまざまな3Dモデルやオルガノイドを損傷することなく構築し、取り扱うことができる。そのリキッドハンドリングツールは、ハイドロゲル、マトリゲル®、または他の適切な細胞外マトリックス中の規定数のセルを、マルチウェルプレートに効率的に分注します。そこから培地追加や交換、プレート搬送を行い、基礎、薬理学、生物医学ワークフローを実行するスマートな統合自動ワークセルに組み込むことができる。
この研究では、96ウェルフォーマットの細胞を用いて3D細胞構造をプリントするために、VitroGel®マトリックスを使用した。The Well Bioscience社のVitroGelは、3D細胞培養環境を操作するための最大限の柔軟性を可能にする、調整可能なゼノフリー(動物由来でない)バイオ機能性ハイドロゲルシステムである。温度依存性がなく、マトリゲルのような動物由来の細胞外マトリックス(ECM)の優れた代替品であり、幅広い細胞種とエンドエンド構造の要求に対応できる。VitroGelのユニークな剪断減粘性と急速回復レオロジー特性は、分注後の優れた細胞分布を可能にし、自動リキッドハンドリングシステムでの使用を極めて容易にします。
この研究では、患者由来のトリプルネガティブ乳がん細胞(引用)をVitroGelマトリックスと混合し、96ウェルフォーマットのバイオプリンティングで3D培養を行った。
VitroGelを用いた3D細胞モデルのワークフローを、分注、モニター、薬剤スクリーニングアッセイの実施、画像化、データ解析のためのデータインテリティグシステムで紹介する。このシステムにはBAB400とImageXpress® Micro Confocalシステムが含まれる(図1)。
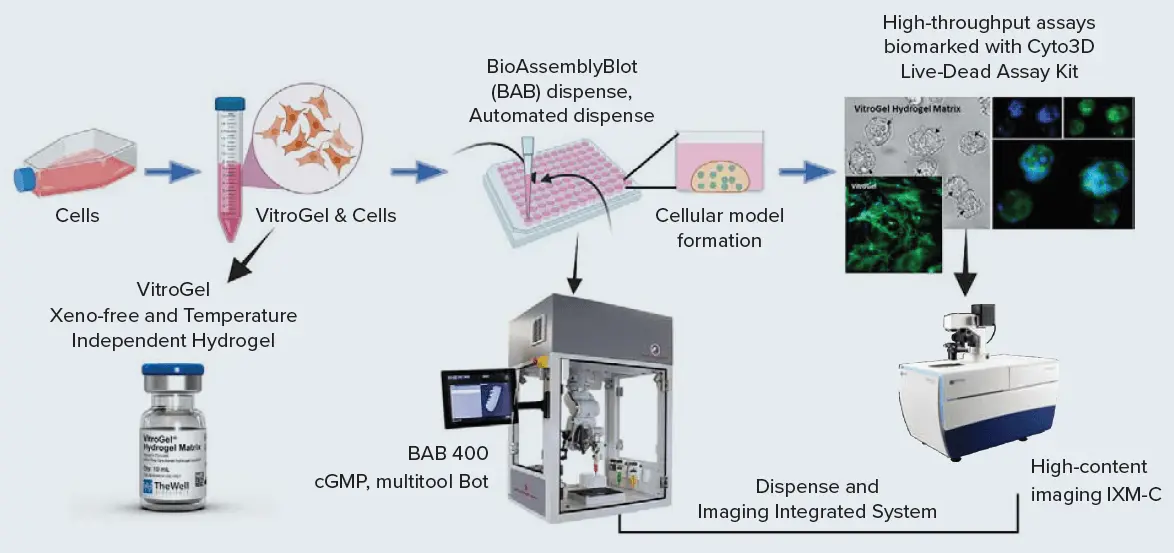
図1. 統合システムワークフローの模式図[BABによる自動分注とIXM-Cによるイメージング]。
方法
スフェロイド用VitroGelおよび細胞懸濁液
4IC細胞1は、グルコース、NEAA、2mMグルタミン、インスリン120μg/L、10%FBSを補充した上級DMEMで培養した(Gibco 12491-015)。アッセイのために、スフェロイドはDMEM+10%透析血清(2mMグルタミン、5mMグルコース、フェノールレッドなし)で培養した。
患者由来のトリプルネガティブ乳がん細胞をトリプシンを用いて採取し、30%FBSを含む培地に5 X 105 cells/mLの濃度で懸濁した。3D細胞培養は、VitroGel Hydrogel Matrix(SKU:VHM01)を用いて以下の手順で行った:
- VitroGel Hydrogel Matrixを室温に戻すか、37℃に温める。
- ハイドロゲル溶液とセル懸濁液を2:1(v/v)の割合で混合する。
- ハイドロゲル-細胞混合液を96ウェルプレート(非組織培養処理)の各ウェルに10μLずつ添加する。
- ハイドロゲル形成まで室温で10-15分待つ。ハイドロゲル形成中、ウェルプレートを傾けたり振ったりしてハイドロゲルを乱さない。
- ハイドロゲルの上に90μLの細胞培養メデュームを注意深く加える。
- ウェルプレートをインキュベーターにプレーティングし、カバーメディウムを1日おきに交換する。
BioAssemblyBot 400:分注(ピペットツール)、培地交換、薬物スクリーニング、生死アッセイ用
BAB400は、HEPAエアフローシステムで無菌環境を提供します。ツールや電子機器を除く表面をスプレーして拭き取り、使用する1時間以上前(一晩が望ましい)にHEPAフィルター機能をオンにします。BAB400のヒューマンマシンインターフェース(HMI)とジョイスティックコントローラーを使用して、さまざまなステップに異なるパスを設計できます。リザーバー、プレート、チューブ、ゴミ箱などの座標を記録するコンソールを使って、希望するワークフローごとにパスを設定する。VitroGelの培地とセル懸濁液はあらかじめBAB400で調製され、リザーバーに移される。
グリッパー(PnPツール) シーケンスは、BAB400を使用して、プレートの蓋を外し、蓋をし、分注が完了したらイメージングシステムのImageXpress® Micro Confocalシステムにプレートを移動するために使用することができます。BAB400には、マルチステッププロセスを人手を介さずに実行するオプションがあります。カスタム実験プロトコルをつなぎ合わせて3D細胞モデルを構築することで、実験を自動ワークフローにすることができます。BioApps™ Makerは、3Dモデルの独立した分注、メンテナンス、イメージングの一連のステップを自動化するために使用された、作りやすく自動化しやすいソリューションです。
例えば、ハイドロゲルの分注シークエンス手順が示されている:
チップを入手→ピペットツールがハイドロゲルリザーバーへ移動→ダウン(リザーバーへ)→Y回混合(吸引の後、定義した速度でディスペンス)→プレートへ移動(左/右/方向→ウェルセンター)→ディスペンス(量とディスペンス速度を定義)→チップをゴミ箱へ(BAB400のバイオハザードバッグへ)。VitroGelドームを無傷に保つため、チップはウェルの端まで移動します。スフェロイドのさらなる治療やイメージングアッセイには、選択薬剤やLive/dead stainを添加した培地を使用することもできる。オプションのステップ 96ウェルに分注したVitroGel液滴をより速くゲル化させるために、BAB400の温度制御ステージを10℃に予冷する。
ImageXpress Micro コンフォーカルイメージングと解析
BAB400でマイクロウェルプレートをImageXpress Micro Confocal イメージャー(Molecular Devices)に移動した後、MetaXpress® ハイコンテント画像取得・解析ソフトウェアを用いて透過光(TL)画像または蛍光画像を取得した。スフェロイドのZ-スタック画像は、共焦点モードを使用して4Xまたは10X対物レンズで取得した。すべての解析にMetaXpress® 画像解析ソフトウェアを使用した。BioApps™は、特定のシーケンスや実験に適した画像取得および解析ファイルを事前に選択し、プルアップして実行することができます。
結果
複数の96ウェルプレートに4IC乳がん細胞をプレーティングし、BAB400と手動の両方でVitroGelドームをセットした。これらの細胞は3日目にCyto3D® Live-Dead Assay Kit(TheWell Bioscience社、SKU:BM01)染色を用いて生細胞数と死細胞数を観察し、上述のイメージング法を用いて解析した。ライブデッド解析は、生細胞と死細胞のカウントに用いられた。手作業でプレーティングしたセルと自動プレーティングしたセルとでは、細胞生存率に有意差はなかった。BAB400ワークフローの平均生存率は93%であったのに対し、手動で分注したウェルプレートの生存率は92.4%であった(図2)。したがって、自動細胞プリントは細胞生存率に影響を与えなかった。
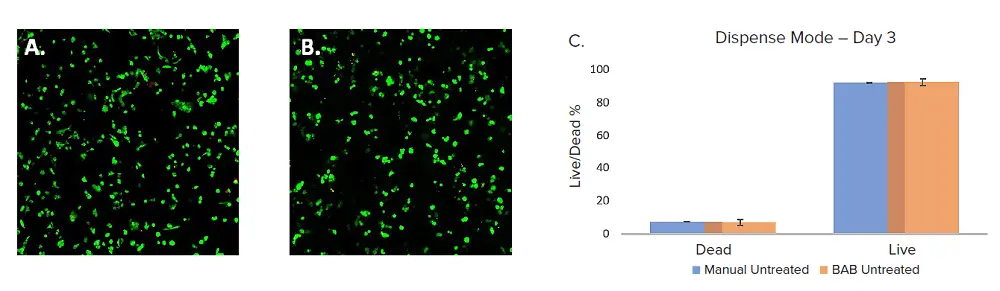
図2. A. BAB B. 手動で分注したVitroGelとトリプルネガティブ乳がん細胞(4IC)をCyto3D(緑-生、赤-死)で染色し、IXM-Cを用いて3日目にイメージングしたもの。MetaXpress®ソフトウェアを用いて解析したデータのグラフ表示。
薬物処理のワークフローをテストするため、3日目にTrametinibとIdarubicinという薬物を最終濃度4μMになるようにマルチウェルプレートに添加し、48時間処理後の5日目にその効果を評価した。いずれの薬剤処理においても、コントロールと比較して細胞生存率の有意な低下が観察された(図3)。細胞生存能は、上述のように生存率色素で染色した後、イメージング法により決定した。イダルビシン4μMにおける死細胞の割合は最も高く、スフェロイド中の細胞の97%が死滅していたのに対し、トラメチニブの場合は66.4%、コントロールは7.5%であった(図3)。
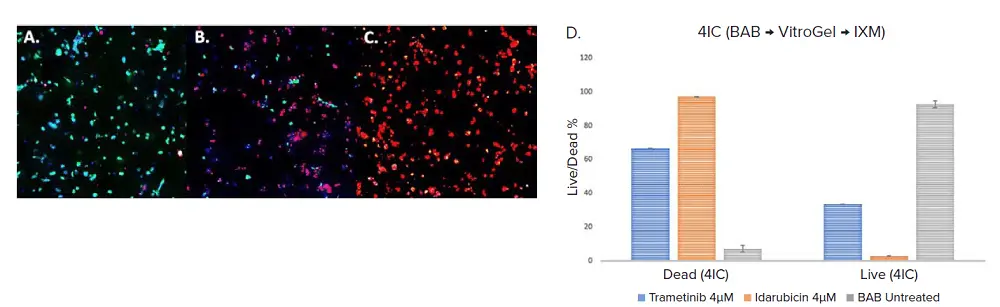
図3. 細胞はBAB(VitroGelおよびトリプルネガティブ乳がん細胞(4IC))で分注した。コントロール(A.)と処理サンプルは、Cyto3D ( 緑 - 生存、赤 - 死滅 )とDAPI (青 - 核)で染色し、処理 - 4μM濃度のトラメチニブ(B.)とイダルビシン(C.)で48時間処理した。これらを5日目にIXM-Cを用いて画像化した。MetaXpress®ソフトウェアを用いて解析したデータのグラフ表示。
結論
BAB400とImageXpress Micro Confocalイメージャを、取り扱いが簡単で調整可能なECMマトリックス(VitroGel)と統合することで、化合物スクリーニングや様々なアッセイに使用できる3D細胞モデルの2D/3D細胞培養、維持、分化のための3D細胞モデルワークフローを自動化することができます。これにより、時間とコストを節約し、繰り返しのステップを減らすことで、現在進行中の基礎研究、薬理学研究、生物医学研究、製品開発に効果的に貢献します。
謝辞
Matthew E. Burow博士(医学部准教授、Tulane Cancer Center Program Member)より患者由来の細胞株の提供を受けた。
参考
- Cromwell EF, Sirenko O, Nikolov E, Hammer M, Brock CK, Matossian MD, Alzoubi MS, Collins-Burow BM, Burow ME. 疾患モデリングのためのトリプルネガティブ乳がん患者由来腫瘍体の多機能プロファイリング、SLAS Discovery 2022; 27(3): 191-200.
PDF版(英語)