Application Note iPSC由来3D大脳オルガノイドの自動発生
モニタリングと活性解析
PDF版(英語)
はじめに
Angeline Lim | Sr. Applications Scientist | Molecular Devices
Oksana Sirenko | Sr. Manager of Assay Development | Molecular Devices
ヒトの脳は非常に複雑であるため、in vitroでもモデル生物でも研究が困難である。培養ニューロンは、脳の3次元(3D)構造、複雑さ、微小環境を十分に再現していない。また、モデル生物の使用は、保存された発生経路のいくつかの要素を定義するのに役立っているが、加齢に関連した神経疾患など、特定の疾患を研究するのに適したモデルは不足している。
しかし、人工多能性幹細胞(iPSC)由来の脳オルガノイドの使用は有望なモデルであり、ヒトの神経発達の側面を再現し、個別の脳領域に自己組織化し、その遺伝子発現パターンはin vivoデータと類似している1,2。これまでの努力により、脳オルガノイドを培養するためのいくつかのプロトコールや、脳の発達とそれに関連する疾患の研究を可能にする技術が開発されてきた。特に、大脳オルガノイドを培養できるようになったことで、ヒトの皮質の発達とそれに関連する疾患の研究が可能になった。大脳オルガノイドを機能ゲノム研究、創薬、化合物誘発毒性作用の研究に大規模に用いるには、さらなる研究が必要である。
ここでは、大脳オルガノイドの半自動培養とモニタリング、およびCa2+オシレーションの記録による機能的神経細胞活動の検査法について述べる。脳オルガノイドは既報の方法でiPS細胞から開発した2,3。我々の方法は、ImageXpress® Microハイコンテントイメージングシステムを用いた部分自動ワークフローと培養モニタリングに適応した。発達中の脳微小組織のサイズと形態を、発達の20週間にわたって透過光でモニターした。IN Carta®画像解析ソフトウェアによるディープラーニングベースの画像解析は、組織のサイズと形状の定義に使用された。Sox2、TuJ1、GAFPマーカーの発現による共焦点イメージングを用いて、発達の異なる段階における選択した微小組織を分析した。機能的活性を検出するために、微小組織の選択されたクラスタリングからのカルシウムオシレーションをイメージングによって記録した。オシレーションは培養50日目以降に観察され、微小組織の体積を通して散発的であった。
材料と方法
セル培養
フィーダーフリーの条件にアダプターしたヒトiPSC細胞(SC102A-1、System Biosciences)を解凍し、Complete mTeSR™ Plus培地(STEMCELL Technologies)を用いてマトリゲルコートプレート(cat. #354277、Corning)で培養した。培地交換は、1週間に1回、培地交換を省略するために2倍量の培地を加える場合を除き、毎日行った。細胞は、酵素フリー試薬ReLeSR™(STEMCELL Technologies社製)を用い、1:6-1:10の分割比で4-5日ごとに継代した。
大脳オルガノイドの分化
大脳オルガノイドの作製に使用した試薬はすべてSTEMdiffTM Cerebral Organoid Kit(STEMCELL Technologies #08570)のものである。このキットは、Lancasterら1に基づいて大脳オルガノイド形成用に最適化されている。簡単に説明すると、iPSC細胞を96ウェル超低接着プレート(コーニング)の胚様体(EB)播種培地に9000細胞/ウェルでプレーティングした。培地をEB形成培地に交換した。5日目にEBを画像化し、神経誘導の準備ができたことを確認した。EBを誘導培地を封じ込めた24ウェルプレートに移しました。7日目に、EBをマトリゲル(コーニング社製)の液滴に移した。約6~8個の液滴を、Maturation培地を封じ込めた6ウェルプレートの各ウェルにプレーティングした。オルガノイドを封じ込めたプレートは、37℃のインキュベーター内で環状シェーカーで成熟させた。新鮮な培地は3-4日ごとに交換した。
カルシウム流動アッセイは、FLIPR® Calcium 6 Assay Kit(Molecular Devices社製)を用い、メーカーのプロトコールに従って行った。17日目から、大脳オルガノイド1個に色素を2時間負荷し、ImageXpress Micro Confocalで撮影した。
カルシウム流動アッセイ
カルシウム流動アッセイは、FLIPR® Calcium 6 Assay Kit(Molecular Devices社製)を用い、メーカーのプロトコールに従って行った。17日目から、大脳オルガノイド1個に色素を2時間負荷し、ImageXpress Micro Confocalで撮影した。
免疫蛍光
オルガノイド全体を4%PFAで4℃、一晩固定し、その後PBSで素早く洗浄した。PBS中の0.5%トリトン-Xで透過安定化した。オルガノイドを以下の抗体と染色液で48時間インキュベートした: Hoechst(33μM、Invitrogen cat.#33342)、Alexa Fluor 555マウス抗ß-チューブリン(1:100、Becton Dickinson cat.#560339)、Alexa Fluor 647マウス抗Sox2(1:100、Becton Dickinson cat.#562139)、Alexa Fluor Plus 750ファロイジン(ThermoFisher Scientific cat.#A30105)。
画像取得と解析
すべての画像は、MetaXpress® ハイコンテント画像取得・解析ソフトウェアを用いて、ImageXpress Micro Confocal システム(Molecular Devices)で取得した。全ての解析には IN Carta™画像解析ソフトウェアを使用した。画像のセグメンテーションにはIN Carta SINAPモジュールを使用した。各モデルは、解析プロトコールで使用する前にトレーニングされ、検証された。カルシウムイメージングでは、カメラのビニングを2に設定して画像を取得した。取得速度を上げるため、50μm共焦点スリットモジュールを使用した。
研究成果
iPSC由来大脳オルガノイドの培養と分化。
大脳オルガノイドは、Lancasterらのプロトコール3に従って培養される。この方法では、オルガノイドは自己組織化とパターニングを促進する培地で培養される。胚様体は細胞外マトリックス(マトリゲル)中でさらに分化させ、神経上皮の偏光を改善し、大きな神経上皮芽の成長をサポートする。これらの芽はEBから伸長し、脳室と同様の空洞を封じ込めた。図1は、iPSC由来の大脳オルガノイドを作製するための主な手順を示している。

図1.内在性パターニングアプローチを用いて作製したiPSC由来大脳オルガノイド。A) iPSC由来大脳オルガノイドの作製に用いた主な手順。使用したプロトコルは、STEMCELL Technologies社の培地を用いたLancaster & Knoblich, 2014に基づく。B) 5日目までに、EBの大部分は少なくとも直径400μmになった。EBは滑らかな外形を示し、表面近傍の領域は(明視野顕微鏡で)光学的に明るくなっていた。右はプレーティングによるEBの拡大例。スケールバー=100μm。C) 神経誘導培地に移した後のEBの画像。光学的に半透明のエッジは神経上皮の形成を示唆する。スケールバー=100μm。D) 8-10日目から、オルガノイドをマトリゲルに包埋し、神経上皮の拡大をサポートした。多数の上皮芽の形成に注意。E) オルガノイドを環状振盪器に移し、成熟させた。成熟中の大脳オルガノイドをデジタルイメージングした。F) オルガノイドを固定し、Hoechst(核、青)、TUJ1(ニューロン、緑)、SOX2(放射状グリア、赤)で染色した。画像を横切る暗線は画像タイリングの結果。
AIベースの解析ツールを用いて、発達中の大脳オルガノイドをモニターする
発生中のオルガノイドの質をモニターするため、AIベースのセグメンテーションを用いて明視野イメージングで得られた画像を解析した。EBやオルガノイドの成長は、経時的に直径を測定することでモニターできる。EBの同定にディープラーニングベースの手法を用いる利点のひとつに、よりロバスト性の高いセグメンテーションがある。このモデルは、ほとんどの破片、塵粒子、撮像アーチファクトを除外するように訓練されている。
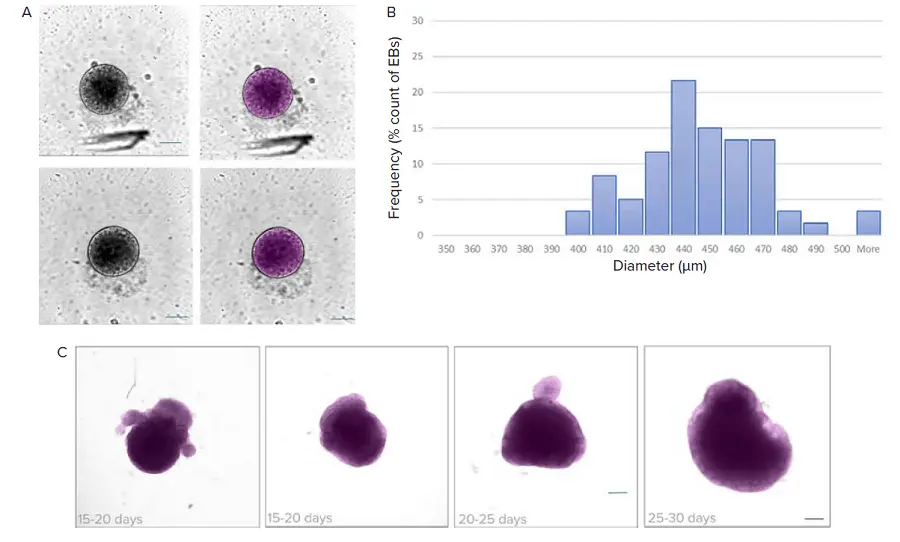
図2. ディープラーニングベースのセグメンテーション(SINAP)を用いた明視野画像の解析。A) 神経誘導ステップに進む前に、EBの大きさをモニターした。IN Carta™ソフトウェアのSINAPツールを用いた画像と対応するセグメンテーションマスク(マゼンタ色)の例を示す。B) ヒストグラムはEB直径の分布を示す。ビンサイズ=10μm。C) 明視野イメージングを用いてオルガノイドの成熟をモニターし、IN Carta SINAPツールを用いて解析することができる。カスタムディープラーニングモデルをトレーニングし、データセットに適用した。セグメンテーションマスク(マゼンタ)を用いたオルガノイドの例。SINAPモデルは、異なる形や大きさのオルガノイドのセグメンテーションが可能であることに注意。スケールバー=100μm。
オルガノイドを構成するセルタイプを決定するために、選択したオルガノイドを固定し、様々な時点でSOX2(放射状グリア)、TUJ1(ニューロン)、Hoechst(核)で免疫染色した。大脳オルガノイドは、発達中の脳を思わせる組織を示した。放射状グリア細胞はオルガノイドの脳室を取り囲んでいる。古いオルガノイド(8週目)では、成熟していないオルガノイド(4週目)に比べて脳室は大きかったが、数は少なかった。(図3)。
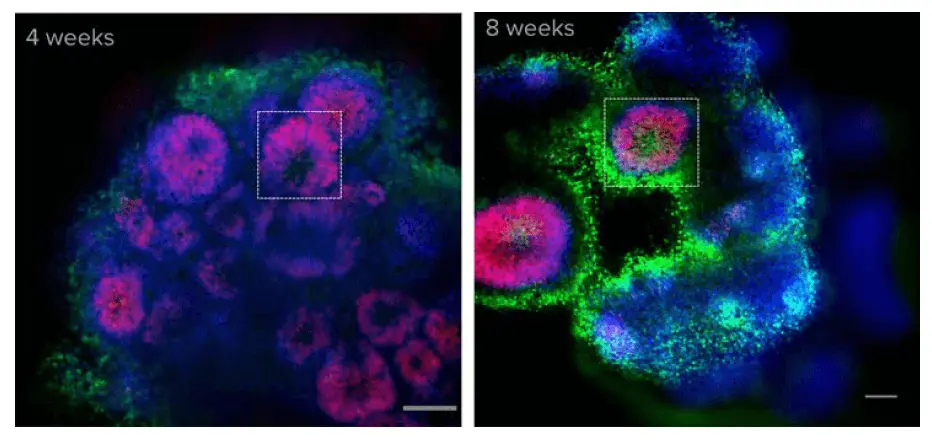
図3. 大脳オルガノイドは、発達中の脳を思わせる組織を示す。カルシウムイメージングの後、オルガノイドを固定し、Hoechst(青)とSOX2(放射状グリア、赤)で染色した。ここに示すのは光学的切片の1つである。4週齢と8週齢の両方のオルガノイドで心室(枠で囲んだ部分)が観察できる。SOX2染色は、放射状グリア細胞が脳室付近に局在していることを示しており、これは発達中の大脳皮質における細胞組織と同様のパターンである3。
全脳オルガノイドのカルシウムイメージング
4週目から、FLIPRカルシウム6色素を負荷した脳オルガノイドのカルシウム活性を観察した(図4)。(図4)。カルシウム活性の頻度は低く、この時点ではオルガノイド内の神経細胞はまだ未成熟であることが示唆された。13週目には、カルシウム活性はより同期しているように見え、ニューロンが機能的なネットワークで相互接続していることが示唆された(図5)。
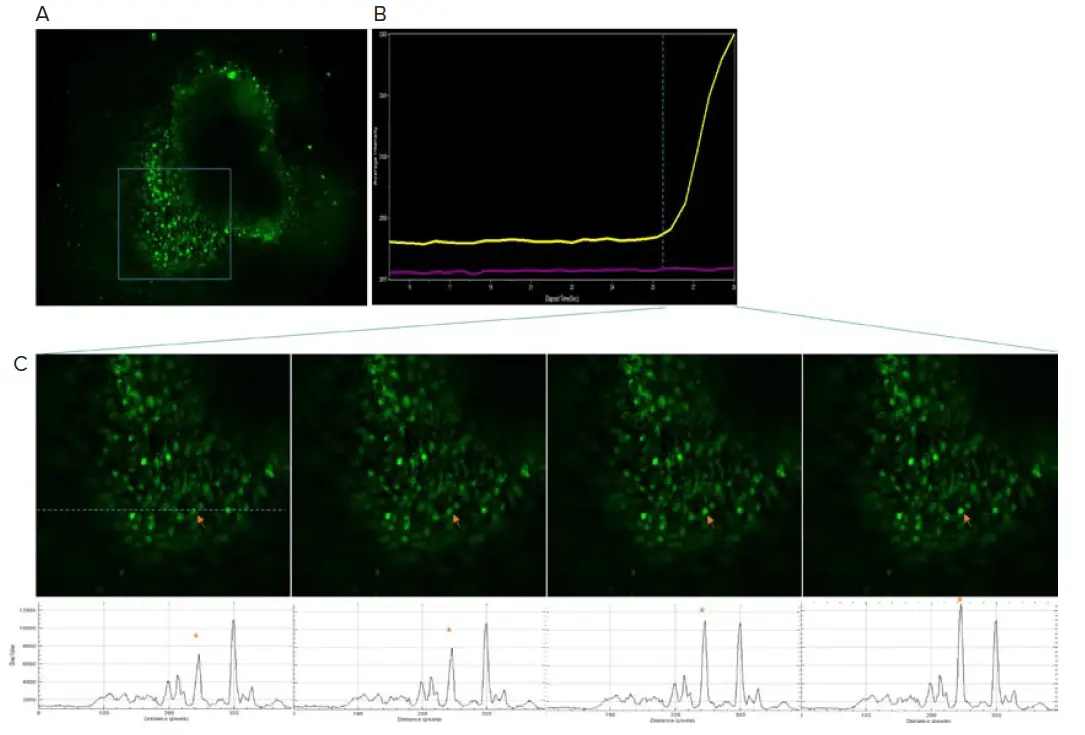
図4. 4週目にはカルシウム活性が認められた。A) オルガノイドにFLIPRカルシウム6色素を添加し、ImageXpress® Micro Confocalシステムでカルシウムフラックス活性をモニターした。B) カルシウム強度の経時的プロットを右側に示す。黄色のトレースは(C)の矢印で示す領域に対応する。紫色のトレースは近傍の領域を示す。C) (A)の枠で囲まれた領域のクローズアップ図。下部の点線に沿った強度プロファイル。矢印は強度プロファイルのアスタリスクのピークに対応する。
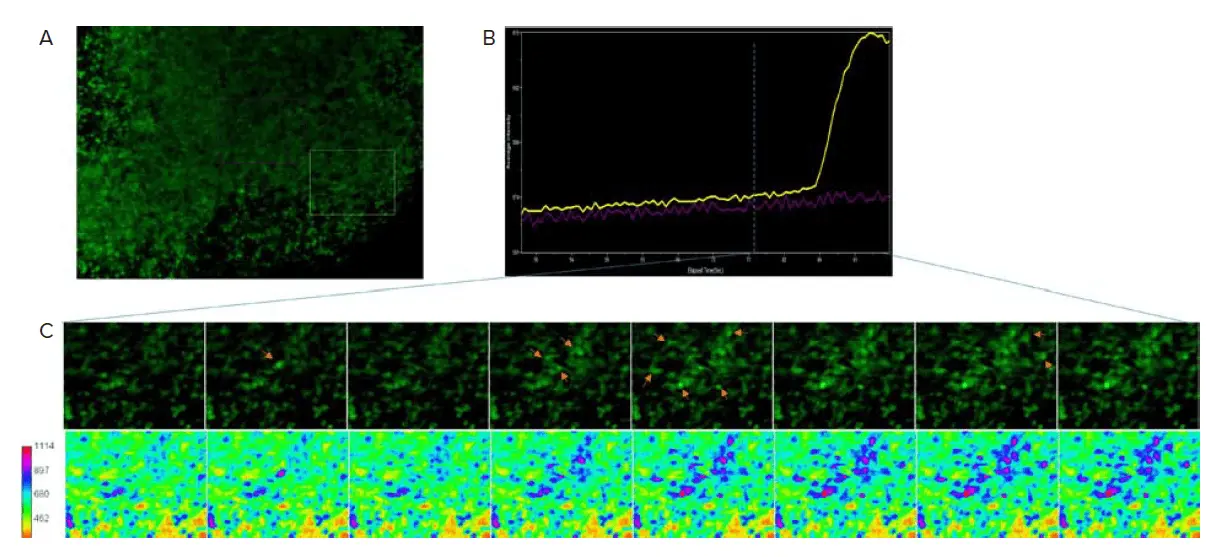
図5. 13週目までのカルシウム活性の同期。A) 画像はカルシウム6を負荷したオルガノイドの光学的断面。B) 箱で囲んだ領域のカルシウム強度を経時的な平均強度として表したもの。C) (A)のボックス領域のクローズアップ図を経時的に示す。矢印は強度の上昇を示す。下の画像はカルシウム強度をヒートマップとして表したもの。最初のスパイクから強度が広がっていることから、神経細胞ネットワークの存在が示唆される。
これらの大脳オルガノイドを毒性研究に使用する可能性を探るため、オルガノイドを4-アミノピリジン(神経刺激薬)やムシモール(神経抑制薬)などの化合物とインキュベートした。場合によっては、4-APはカルシウム活性の活性化につながった(図6)。

図6. 神経刺激物質によって引き起こされるカルシウム活性。A) オルガノイドを100nMの4-APで30分間インキュベートした後、画像化した。多数のカルシウムシグナル伝達イベントが観察された。枠で囲んだ領域は、カルシウムスパイクが観察された領域を示す。対応する強度プロファイルを以下に示す。B) ムシモールで処理したオルガノイド。ムッシモールを除去した後のカルシウム活性の回復の一例を示す。GABAの抑制効果は、オルガノイドの活性が過渡的で一貫性がないため、結論は出なかった。カルシウムシグナルイベントを強度プロファイルとともに枠で囲んだ領域に示す。
結論
- われわれは、大脳オルガノイドの自動イメージングと発生モニターに使用したワークフローとツールをここで示した。
- カルシウムフラックスの存在とオルガノイド内のセル組織は、in vivoの大脳皮質発生と一致している。
- カルシウムフラックスの存在とオルガノイド内のセル組織は、in vivoの大脳皮質発生と一致している。
参考文献
- Gordon, A., Yoon, SJ., Tran, S.S. et al. ヒト大脳皮質オルガノイドの長期成熟は、生後早期の重要な移行と一致する。Nat Neurosci 24, 331-342 (2021).
- Lancaster、M.、Renner、M.、Martin、CA.ら、大脳オルガノイドはヒトの脳発達と小頭症をモデル化する。Nature 501, 373-379 (2013).
- Lancaster MA, Knoblich JA. ヒト多能性幹細胞からの大脳オルガノイドの作製。Nat Protoc. 10月 9(10), 2329-40 (2014)
- 神経細胞におけるカルシウムのイメージング。Neuron 73, 862-885 (2012)
PDF版(英語)