Application Note Matrigel®における
3次元細胞培養の生成と解析の自動化
PDF版(英語)
はじめに
Michael Kowalski(ベックマン・コールター・ライフサイエンス、インディアナポリス、スタッフアプリケーションサイエンティスト
Kayla Hill、セルラーイメージングフィールドアプリケーションサイエンティスト、Molecular Devices、カリフォルニア州サンノゼ
Kristin Prasauckas、フィールドアプリケーションサイエンティスト、マネージャー、Molecular Devices、カリフォルニア州サンノゼ
タラ・ジョーンズ=ロー、マーケティング・マネージャー、ベックマン・コールター・ライフサイエンス、インディアナポリス
研究者たちは、疾患モデルの生物学的妥当性を高め、薬剤研究の予測的価値を高める方法として、3次元(3D)細胞培養に注目している1。このような3Dモデルは通常、細胞間相互作用のレベルを高め、標準的な単層培養で見られる支配的な細胞-塑性相互作用を減少させるか、あるいは排除する。3D細胞培養の生成には多くの方法があり、それぞれにユニークな利点と課題があるが、その多くは自動化によって克服することができる。
三次元空間でセルを培養する一般的な方法の一つは、マトリゲル のような細胞外マトリックスベースのハイドロゲルを使うことであ る。マトリゲルと2次元細胞培養の違いは、細胞形態(図1)、細胞偏光、および/または遺伝子発現の違いによって容易に見ることができる(2Baker and Chenに総説あり)。マトリゲルは、血管新生研究における内皮細胞チューブ形成のような、セル遊走や3D構造形成の研究も可能にする3,4。
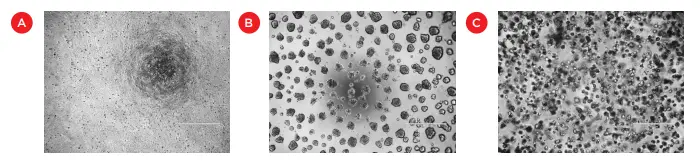
図1. 標準的な細胞単層培養(A)、マトリゲル表面(B)、マトリゲル層内(C)で増殖したHCT116細胞のイメージング。バーは500μm。
Matrigelのユニークな性質の一つで、その扱いを難しくしているのは、低温でのみ液体であり、室温または37℃でゲル状に固まることである。細胞は通常、マトリゲルのコーティングの上か、マトリゲル の厚い層の中に埋め込まれて培養され(図1)、補足培地は通常、 凝固後のハイドロゲル層の上に加えられる。マトリゲル中で増殖した細胞のアッセイにも問題がある。プレートリーダーやイメージングデバイスを使ってマトリックス中にある細胞を調べるか、マトリゲルをゆっくり溶解して懸濁液や細胞溶解液で細胞を処理する方法がある。これらのステップの全ては、手作業で行う場合には重大な課題があり、分析のためにマトリゲル培養のプレーティング、処理、準備に自動化をどのように利用したかについて述べる。加えて、自動化によって384ウェルプレートの使用が可能になり、それによって条件ごとに使用されるマトリゲルや他の高価な試薬の量を減らすことによって、大幅なコスト削減がもたらされた。
概要
- Biomek FXでマトリゲル培養のプレーティング、薬剤処理、染色を自動化した。
- P
- ワークステーション
◦温度制御位置はマトリゲルを液状に保ち、ゲル化を誘導した
◦ピペッティングの最適化により、マトリゲル使用量の削減によるコスト削減を実現 - 以下を用いて、マトリゲル培養におけるセル増殖とアポトーシス誘導を測定した:
◦SpectraMax i3X マルチモード検出プラットフォームと SpectraMax MiniMax 300イメージングサイトメーター
◦ImageXpress® マイクロコンフォーカルハイコンテントイメージングシステム
マトリゲルの自動プレーティングと培養
マトリゲルワークフローは、96チャンネルヘッドとSpan-8ピペッターを備えたBiomek FXPワークステーション(Beckman Coulter)で自動化した(図2)。フレキシブルなBiomekワークステーションは、マトリゲルを液状に保ち、アッセイプレートを加熱してゲル重合を誘導するために、多数の温度制御ペルチェポジションで構成された。96チャンネルのヘッドには、マルチチャンネル・セレクティブ・チップ・ピペッティング(EST)が搭載され、あらゆるパターンのチップを使用することができる。自動細胞操作の無菌性は、滅菌BiomekピペットチップとHEPAフィルター付きエンクロージャーの使用により保護され、細胞培地中に抗生物質がない場合でも混入は検出されなかった。
セルプレーティング
氷上で解凍したフェノールレッドフリーのマトリゲル(セルニン グ社製)をFluoroBrite DMEM培地(サーモフィッシャーサイエンティフィック社製) で6mg/mLに希釈し、埋め込み培養にはHCT 116細胞を100,000細胞/mLの濃度になるように加えた。マトリゲル(+/-細胞)を、ディープウェルアダプター付き振とうペルチェ装置で4℃に保たれたディープウェルプレートのシングルカラムに添加した。25μLを、マルチチャンネルEST機能を用いて、384ウェル黒壁クリアボトムプレート(Greiner社製)のウェルにカラム単位で添加した。このアッセイプレートを静置ペルチェで37℃に30分間加熱し、マトリゲルを固化させた。その後、10%FBSを封じ込めた75μLのFluoroBrite DMEM培地を各ウェルに添加した。マトリゲル表面で増殖させた培養では、HCT 116セルはマトリゲルではなく補助培地に添加した。最終的な細胞プレーティング数は、埋め込み培養では2500細胞/ウェル、表面培養では8000細胞/ウェルであった。
上述のように、マトリゲル培養のプレーティングには多くの課題がある。自動化では、ピペットチップをウェルの底から0.3 mmの高さに一貫して置くことができたので、少量のマトリゲルがウェル全体を覆うように広がった。手動のピペッティングでは、ウェルの底(傷がついたり、移動量に影響したりする可能性がある)かウェルの側面に接触させる必要があり、その結果、マトリゲル液滴が側面に付着してウェルを覆うことができなかった。手作業で安定したウェルカバレッジを達成する唯一の方法は、マトリゲル量を2倍の50μLにすることで、実験のコストを2倍にすることだった。
自動プレーティングのもう一つの利点は、マトリゲル溶液中に気泡を発生させないために、吸引、分注、混合の速度を遅くできることであった。また、アッセイプレートに分注する際に気泡が入らないように、少量のマトリゲルをピペットチップに追加吸引した。気泡はMatrigel培養でよく見られる苦情であるが、自動プレーティング直後の培養では気泡は見られなかった。培養液は5%CO2インキュベーター内37℃で、処理および/または分析前に様々な時間保存された。
セル増殖アッセイ
マトリゲル表面培養の初期細胞増殖を測定するため、培養開始後3日間、毎日ウェルに100μLのXTT試薬を添加した。SpectraMax i3X Multi-Mode Detection Platform(「SpectraMax i3Xリーダー」、Molecular Devices、図2)を用いて、475 nmと660 nmで吸光度を測定した。直線的な増殖速度が見られ(R2 = 0.985)、この時間枠で 8000 個のセルが一貫して増殖していることが示された(図 3A)。3日目に吸光度がわずかにプラトー化したのは、増殖の鈍化を反映し ている可能性もあるが、それよりもXTTアッセイの吸光度が最大に 近づいていることを示している可能性の方が高い。

図2. Biomek FXP Workstation(左)を用いてマトリゲル培養のプレーティング、処理、染色を行った。これらの培養物は、SpectraMax i3XリーダーとMiniMaxサイトメーター(中央)またはImageXpress® Micro Confocalシステム(右)を用いて解析した。
XTTアッセイはエンドポイントアッセイであるため、標識不要の方法で細胞増殖を追跡することも追求した。SpectraMax MiniMax® 300イメージングサイトメーター(「MiniMaxサイトメーター」、Molecular Devices社製)とSpectraMax i3Xリーダーを利用して、表面コロニーがウェルに占める割合を測定した(「フィールド」分析設定)。プレーティングしたマトリゲルがわずかに凹んでいたため、明確な焦点面が得られなかったが、表面コロニーのコンフルエンスの経時的変化は容易に検出できた(データは示さず)。さらに重要なことは、これらの培養のコロニー形態は、セル数が2倍になってもコンフルエンスが2倍にならないようなものであることである。XTTアッセイは、細胞数の増加をより正確に表すかもしれないが、イメージングアプローチは、細胞増殖が安定的に起こっていることを確認するための合理的な代用品として機能する。
フォーカルプレーンがないため、マトリゲルに包埋された培養物をイメージングするのはさらに困難である。しかし、MiniMaxサイトメーターの視野測定を使って、異なる細胞プレーティング数を受けたウェル間の差異を再び確認し、経時的な成長を追跡することができました。図3Bは、細胞が存在する領域を特定するためにMiniMaxサイトメーターで取得・分析したウェルイメージを示す。3日間にわたり、マスクされた細胞の量が増加しているのがわかる。この増加と他の細胞プレーティング数のコンフルエンスレベルを図3Cにプロットした。ここでも、細胞数の増加の直接的な測定にはならないかもしれないが、成長曲線の高い直線性(R2値は0.968から0.999)とプレーティング細胞数間の明確な分離は、このアプローチが標識不要の方法で埋め込みマトリゲル培養における細胞成長を追跡するために使用できることを示唆している。
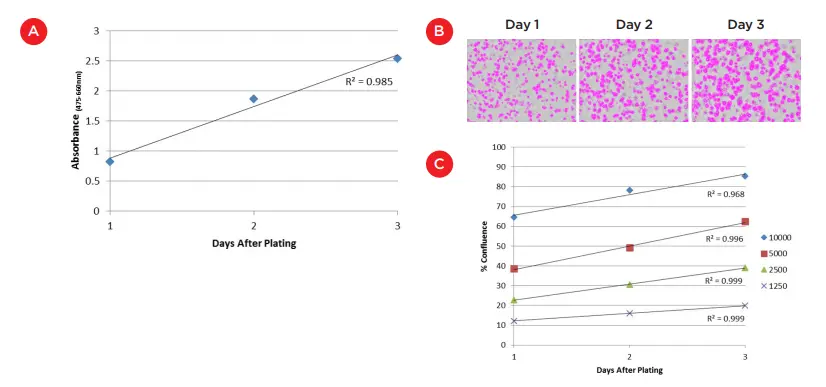
図3. マトリゲル上での細胞増殖の解析。A) 3日間にわたりマトリゲル表面で増殖した8000細胞のXTTアッセイ。XTT試薬で4時間インキュベートした後、SpectraMax i3Xリーダーで吸光度を測定した。B) Matrigel内にプレーティングしたHCT 116細胞のコンフルエンス測定を、SpectraMax i3XリーダーとMiniMaxサイトメーターのフィールド解析を用いて測定した。この画像は、3日間にわたる2500細胞のマスク領域の増加を示している。C) 様々な開始細胞数に対するコンフルエンス測定値のグラフ。培養開始3日間のコンフルエンスの変化は、すべての細胞数で高度に直線的であった(R2 0.968~0.999)。
化合物処理とアポトーシス解析
化合物の希釈と添加
3D培養の目的の一つは、より生物製剤に近い系で、細胞が刺激にどのように反応するかを明らかにすることである。われわれは、マトリゲル中で増殖した結腸癌細胞がアポトーシス誘導剤にどのように反応するかを調べようとした。マトリゲル中にHCT116細胞をプレーティングした5日後、アポトーシス誘導化合物をNucBlue® Live ReadyProbes® Reagent(Thermo Fisher Scientific社製)で以下の濃度に希釈した: 10μM staurosporine、20μM camptothecin、375μM 5-fluorouracil。マトリゲル中の細胞核を染色するには長いインキュベーション時間が必要なため、化合物はNucBlueで希釈した。これらの溶液を96ウェル丸底プレートの最初の列に加え、Span-8ピペッターで1%DMSOを封じ込めたNucBlueをプレートの残りの列に移した。その後、ESTを用いて化合物を列ごとに1:3に連続希釈し、最後の列を陰性対照(DMSOのみ)とした。
10μLの培地を100μLの吸引高さから吸引し、吸引中の液面を追った。これにより、マトリゲルを破壊しなかっただけでなく、ピペットの先端が液体に達するまで空気が吸引されるため、蒸発により培地が失われた可能性のあるウェル(端のウェルなど)も、プレートの残りの部分と同じ容量に戻ることができました。この容積の正規化により、10 μLの化合物希釈液を複製ウェルに添加した後、プレート全体で正確な最終化合物濃度が保証されました。
アポトーシス・アッセイ
化合物処理の24時間後、10μLのCellEvent® Caspase-3/7 Green(Thermo Fisher Scientific)を添加し、培養を37℃で6時間インキュベートしてアポトーシス細胞を染色した。細胞画像は、ImageXpress® Microハイコンテントイメージングシステム(「ImageXpress Microコンフォーカルシステム」、Molecular Devices、図2)を用いて取得した。ウェルは、DAPIとFITCフィルターを用いて4倍の倍率で撮像した。この低倍率により、ウェル全体を画像化することができ、Z-スタック画像を取得することで、図4Aに示すように、3次元空間に埋め込まれた細胞を可視化することができた。図4Bは、各誘導剤の上位5希釈液の複製ウェルで撮影した Zスタックの二次元投影図である。これらの投影は、各化合物によって誘導されたアポトーシスの相対的レベルを決定するために、厚さ2mmのマトリゲル層全体に埋め込まれた全細胞(青色核)とカスパーゼ陽性細胞(緑色)の列挙を可能にした。
各濃度におけるカスパーゼ陽性細胞の割合(2反復ウェルの平均)を図4Cに示す。スタウロスポリンとカンプトテシンの両方が最大毒性に達し、伝統的な用量反応曲線を示したので、マトリゲル中に埋め込まれたHCT 116細胞に対するIC50を計算することができた。スタウロスポリンのIC50は6nMであり、カンプトテシンのIC50が80nMであったのに比べ、HCT116細胞に対する毒性はおよそ10倍であった。5-フルオロウラシルの効果はかなり弱く、50%の毒性は3.75μMの最大濃度付近で達したが、IC50値は信頼できないであろう。5-フルオロウラシルのこの弱い効果は、HCT116細胞の3Dモデルを用いた我々の以前の研究でも見られた。
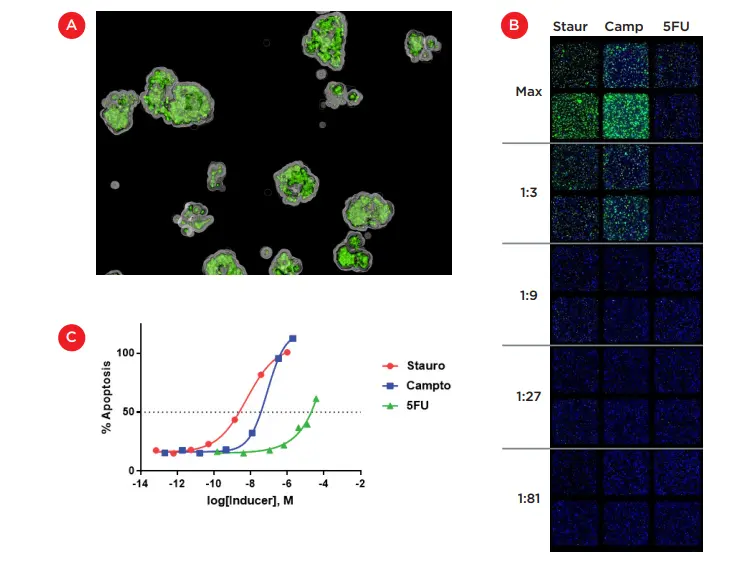
図4. マトリゲル包埋培養におけるアポトーシスの誘導。A) ImageXpress® Micro Confocalシステムを用いて取得した画像。アポトーシスのマーカーとして蛍光カスパーゼ3/7基質で染色した3次元コロニーを示す。B) ImageXpress® Micro Confocalシステムを用いて4倍の倍率で取得したZスタックの2次元投影のモンタージュ。反復ウェルをスタウロスポリン、カンプトテシン、5-フルオロウラシルの希釈液で処理し(上位5希釈液を示す)、細胞核(青)とアポトーシス(緑)を染色した。C) 各化合物のイメージングデータから作成した用量反応曲線。
ディスカッション
マトリゲル培養は、多くの研究において非常に有用である。われわれは、3次元培養した結腸がん細胞におけるアポトーシス誘導の化合物スクリーニングを示したが、マトリゲル細胞培養アッセイでは、血管新生や神経突起伸長の研究など、3次元空間を必要とする他のアッセイも可能である5。しかし、マトリゲルアッセイを利用する上での課題は大きい。我々は、温度制御と相まって、ピペッティングスピードと位置をいかに細かく制御するかによって、自動化がいかに多くの障害を克服できるかを示した。ほんの一例として、自動化によってこれらのアッセイの384ウェルフォーマットへの小型化がどのように可能になったか、そして手動プレーティングや96ウェルフォーマットと比較してマトリゲルの使用量を50%削減することによって、大幅なコスト削減につながったことが挙げられる。この小型フォーマットはまた、より少ない染色試薬を必要とし、96ウェルプレートのウェル全体を捉えるには複数の視野が必要であったため、より速い共焦点イメージングを可能にした。
Biomek Workstationの柔軟性は、多様なワークフローやスループットも可能にする。例えば、マトリゲルアッセイプレートの加熱を1つのペルチェポジションで行ったが、多数のプレートを同時に処理する必要がある場合は、追加のペルチェやインキュベーターを統合することができる。ここで使用したSpectraMax i3XリーダーとMiniMaxサイトメーターやImageXpress® Micro Confocalシステムのような、プレートやチップの保管庫や分析装置を統合することで、ハイスループットのアプリケーションも支援される。
この作業中に、考察に値する追加的な観察がなされた。第一に、マトリゲルのプレーティング中に気泡が混入することはなかったが、ゲル化中にウェルの縁に小さな気泡がいくつか形成された。興味深いことに、この気泡形成の遅れは、マトリゲルを添加しない場合のPBS添加でも見られたので、プレートの特性によるものと思われた。いずれにせよ、自動プレーティングでは、384ウェルプレートにアクセスするために細いピペットチップを使用したにもかかわらず、一貫して手動培養よりも気泡が少なかった。
包埋培養をプレーティングする際、ゲル化が起こる前に、 いくつかの細胞は自然にウェルの底に沈殿し、これらの細胞は単層 培養のように、例えばスプレッド形態を示すかもしれない。理想的な選択肢は、最初にマトリゲルだけの層をプレーテ ィングし、その後にさらにマトリゲルに細胞を埋め込むこと であろう。しかしながら、これはウェルを完全に覆うのに必要な最小容積のため、プレートあたりに必要なマトリゲルのコストがおよそ倍になる。
このような2Dセルを減らす一つの方法は、アッセイプレートをペルチェポジションで予熱することにより、ゲル化プロセスを促進することである。これはまた、384ウェルを一度にプレーティングするのではなく、カラム単位でプレーティングする場合、プレート間の差異を最小限に抑えることができる。しかしながら、この方法ではウェルの端に気泡が多少増えるように思われた。これがプレーティング量や細胞増殖に影響することはないだろうが、XTTアッセイのようなウェルレベルのアッセイでは気泡が検出されず、特に高倍率での画像解析に支障をきたす可能性がある。染色細胞を全細胞に正規化することで、この影響を軽減することができるが、ImageXpress ConfocalシステムでZ-スタック画像を取得することで、実質的にマトリゲルウェル全体を画像化することができ、気泡の存在が不正確な結果をもたらす可能性を劇的に減らすことができる。Zスタック画像取得機能のさらに大きな利点は、取得を開始する高さをコントロールできることである。ウェル底部より高い位置から画像取得を開始することで、2Dセルからのシグナルを除去し、3Dセルだけを確実に解析に含めることができます。
マトリゲル中の細胞をイメージングする際のもう一つの課題は、多くの色素が高レベルのバックグラウンドを与えること、および/または、長いインキュベーション時間を必要とすることであった。これは予想外のことではなく、多くのプロトコールが、細胞を固定し、ウェルをブロッキングし、染色後にウェルを洗浄することを推奨している理由でもある。NucBlue核染料を用いると、長時間のインキュベーションでも生きた細胞を染色できることがわかったので、この試薬は化合物処理時に添加した。また、カスパーゼ3/7試薬は、他の多くの生/死試薬よりもバックグラウンドが少ないと判断した(データは示さず)。これは、この試薬が酵素的に切断されなければ蛍光を発しないため、マトリゲルに結合しても有意なバックグランドシグナルを生じないためであろう。
マトリゲルは3次元培養を研究するための一つの方法に過ぎないが、我々はこの方法が、2次元培養よりも生理学的に適切な系で、アポトーシス誘導剤に対する癌細胞の感受性を測定するためにどのように使用できるかを示した。これらの培養のプレーティング、処理、染色を自動化することで、ベンチでの作業時間と試薬コストを削減し、同時にこの温度に敏感な試薬の難点を克服して、一貫した細胞増殖と測定可能な用量反応曲線を達成した。
参考文献
- Kim YJ, et. 化学感受性試験のためのナノファイバー足場を用いた三次元胃癌細胞培養。Int J Biol Macromol. 45(1):65-71.
- Baker BM and Chen CS. (2012). 第3の次元を解体する:3D培養の微小環境が細胞キューをどのように変化させるか。J Cell Sci. 125(Pt 13):3015-24.
- Chen J, et. (2016). C反応性タンパク質は、CD64/PI3k/AktおよびMAPK/ERKシグナル伝達経路を介してHIF-1αを活性化することにより、ADSC誘導血管新生を促進するためにVEGF発現をアップレギュレートすることができる。Stem Cell Res Ther. 7(1):114.
- Mou Y, et. al. OCT4は、遺伝子発現プロファイルを変化させることにより、HUVECの表現型をリモデリングし、血管新生を促進する。Int J Med Sci. 13(5):386-94.
- Semina Eら(2016)。ウロキナーゼとウロキナーゼ受容体は、神経細胞の移動、軸索の伸長、分岐の制御に関与する。95(9):295-310.
ImageXpress Micro コンフォーカルハイコンテンツイメージングシステムの詳細はこちら >>
PDF版(英語)