Application Note 超低付着プレートでの
3Dスフェロイド培養の自動化
PDF版(英語)
はじめに
我々は以前、ハンギングドロップ法で形成された3Dスフェロイドの自動プレーティング、処理、解析について説明した(Automated 3D Cell Culture and Screening by Imaging and Flow Cytometry, AAG-788APP02.15-A参照)。これらのオルガノイド(図1)は、細胞単層培養よりも生物学的関連性の高いレベルの細胞間相互作用を持ち、固形臓器や腫瘍で見られる拡散勾配をよりよく表現することができる。一貫したハンギングドロップ法をプレーティングし、培地交換中にスフェロイドが吸引されるのを避けるために必要な細かい制御は、自動化によって実現した。また、フローサイトメトリーによる解析のために、スフェロイドを解離させる自動化方法も開発した。


図1. 4000 HCT 116細胞をコーニング社製超低吸着プレートにプレーティングしてから3日後の3次元スフェロイド腫瘍モデルの画像(右)。
ここで我々は、これらの発見を発展させ、細胞がプラスチックのウェルに結合するのを防ぐ超低付着(ULA)プレートでもスフェロイドを形成できることを実証した(図1)。これらのプレートは、ハンギングドロップ法よりも使いやすい利点があるが、スループットを高め、プレーティングの不一致を克服するためには、やはり自動化が非常に有効であった。
ULAワークフローはハンギングドロップ法と同じシステムで自動化され、Biomek FXPワークステーションと96チャンネルヘッド、Span-8ピペッターで構成された(図2)。96チャンネルヘッドには、マルチチャンネルセレクティブチップピペッティング機能が強化されており、あらゆるパターンのチップを使用することができる。Biomekワークステーションのデッキの柔軟性により、ハイスループット応用のための様々なストレージと分析インストゥルメンテーションを統合することができる。Biomek Workstationはまた、操作中のセル培養の無菌性を確保するためにHEPAフィルター付きエンクロージャーに囲まれている。


概要
- Biomek FX P ワークステーションでスフェロイドのプレーティング、薬剤処理、染色を自動化
- ImageXpress ® マイクロコンフォーカルハイコンテントイメージングシステムでスフェロイドの一貫性と薬剤細胞毒性を解析。
スフェロイドの安定性
384 ウェル Ultra-Low Attachment スフェロイドマイクロプレート(コーニング)に、10% FBS を添加した40μL または80μLのFluoroBrite DMEM(Life Technologies社製)に、1ウェルあたり4000個のHCT 116細胞をプレーティングした。スフェロイドは両方の容量で形成され、試薬のコスト削減(40μL)または培地交換なしの培養時間の延長(80μL)により、2つのうちどちらかを選択することができる。ウェル底の気泡をなくすためにミックスステップを加えるなど、ピペッティング技術を最適化することで、すべてのウェルでスフェロイド形成を達成することができた。
ImageXpress® マイクロコンフォーカルハイコンテントイメージングシステム(「ImageXpress マイクロコンフォーカルシステム」、Molecular Devices社製)を用いて、ウェルのスフェロイドの均一性を解析した。プレーティングから3日後、透過光下で192ウェルを10倍の倍率で撮像し(図3)、スフェロイドの大きさ(周囲長および面積)と円形度(形状係数および楕円形状係数)を分析した。この後、NucBlue® Live ReadyProbes® 試薬("NucBlue"、Thermo Fisher Scientific)を2本のカラムに加え、セル核を染色し、スフェロイド体積を算出した(図3)。染色試薬もスフェロイドの拡散勾配の影響を受けるため、内部の細胞の核を十分に染色するには24時間のNucBlue暴露が必要であることがわかった。染色された核を定量化するために、DAPIフィルターを用いてZ-スタック画像を取得した。

表1に測定結果を示すが、変動係数(%CV)はすべての測定と時点において10%未満であった。一貫したサイズと体積を達成したことに加え、スフェロイドは、楕円のフォームファクター(最長径と最短径の比)およびシェイプファクター(真円に近いかどうか)の値が1に近いことが示すように、高い円形度を示した。これらの測定値の一貫性は、192ウェルのうち、スフェロイドがウェル内の破片の周囲に形成されたとき、シェイプファクターが0.75を下回ったウェルは3つしかなかったという事実が示している。
表1.スフェロイドの測定値。
| 3日目の平均値(n=192) | 3日目 %CV | 4日目 平均値(n=32) | 4日目 %CV | ||
|---|---|---|---|---|---|
|
形状 |
形状係数 | 0.84 | 4.00% | 0.81 | 0.8% |
| 楕円形 | 1.11 | 7.70% | 1.06 | 3.5% | |
| サイズ | 周囲長(μm) | 1423 | 4.20% | 1828 | 1.5% |
| 面積(μm2) | 134529 | 5.90% | 216216 | 2.8% | |
| 体積 (μm3) | _ | _ |
5.09x10
7 |
2.7% | |
| 核 | _ | _ | 529 | 9.0 | |
薬剤スクリーニングと解析
薬剤スクリーニングのための一貫したスフェロイドの有用性を実証するために、Biomek Workstationを用いて、様々なアポトーシス誘導剤の1:2連続希釈液を作成した。化合物をNucBlueで希釈し、3日目のスフェロイドを24時間処理(核染色)した。その後、スフェロイドをEarlyTox™ Cell Integrity Kit(Molecular Devices社)の1:1000希釈液で6時間染色した。EarlyTox™キットは、すべての細胞の核を染色するLive Red Dyeと、膜が損傷した細胞の核を識別するDead Green Dyeの2種類のDNAインターカレート色素から構成されています。自動培地除去および化合物/染料の添加は、ウェルの底からスフェロイドが吸引されないように、液面の上部でゆっくりと行われた。ImageXpress®マイクロコンフォーカルシステムを60μmピンホールスピニングディスクとともに使用し、FITC、Cy5、DAPIフィルターを用いて10倍の倍率でZ-stack画像を取得し、生細胞/死細胞の染色を定量化した。
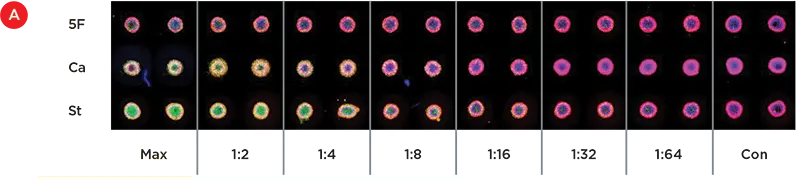
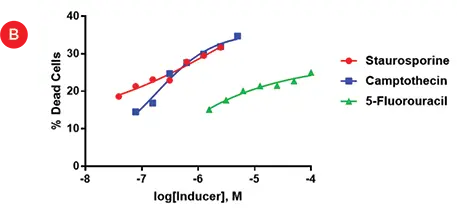
図4Aは、5-フルオロウラシル(最大100uM)、カンプトテシン(最大5uM)、スタウロスポリン(最大2.5uM)の連続希釈液で処理した複製ウェルを示す。スタウロスポリンとカンプトテシンの希釈曲線では、緑色の染色の減少が見られるが、5-フルオロウラシルのウェルでは染色の減少が見られる。これらの結果は、以前これらのスフェロイドで見られたものを模倣している。ImageXpress®マイクロ共焦点システムにより、染色された細胞の列挙が可能であり、毒性の相対レベルが図4Bにプロットされている。
考察
ハンギングドロップ法と同様、超低吸着プレートも、三次元空間での生物学的研究のためにスフェロイドを作製するもう一つの方法である。スフェロイドはより生物学的に関連性の高いモデルを提供できるが、どちらのプレートもその使用には最適化が必要である。ハンギングドロップ法には、プレート操作中に不安定なドロップを失う可能性があるというリスクがあるが、ULAプレートでは気泡がスフェロイド形成を妨げる可能性がある。培地交換の際にスフェロイドが両プレートから失われる可能性があるが、ULAでは容積が大きいため、プレートを手動で使用する場合、これをより避けることができる。どちらの場合も、自動化によって一貫したスフェロイドを作製することができた。ULAプレートでは、ピペッティングの位置精度により、細胞の添加と混合をウェルの低い位置で行うことができ、気泡を防ぐと同時に、細胞の接着を防ぐウェルコーティングを破壊する可能性のあるウェル底との接触を避けることができた。
ImageXpress®マイクロ共焦点システムを使用することで、スフェロイドのかなりの部分について細胞レベルのデータを取得することができ、フローサイトメトリーでこれを達成するためにスフェロイドを解離する必要がなくなった。しかし、スフェロイドを解離しても、スフェロイドへの染色液の浸透に関する懸念は取り除くことができる(前回のアプリケーションノート参照)。スフェロイドの健康状態によって、染色液の浸透性に差が出る可能性があるだけでなく(すなわち、未処理のコントロールは染色に対してより不応性である)、染色液によってはインキュベーション時間が長くなると細胞毒性を生じるものもある。本試験ではNucBlueは有意な毒性効果を示さなかったが、アポトーシス誘導物質がない場合でも、EarlyToxキットに24時間暴露するだけで毒性が誘発された。
ULAプレートをスクリーニングキャンペーンに利用するには、一貫したスフェロイド形成、処理、解析をハイスループットで実現できなければならない。Biomek Workstation上での自動ワークフローは、最小限のベンチ時間でこの一貫性を達成し、ImageXpress® Micro Confocalシステムのような分析装置を統合することで、3次元細胞アプリケーションのためのスクリーンレベルのスループットをさらに可能にすることができる。
ImageXpress®マイクロコンフォーカルハイコンテントイメージングシステムについて詳しくはこちら >>
PDF版(英語)