Application Note ハイブリドーマ技術のための
細胞クローナリティ・スクリーニング
PDF版(英語)
ハイブリドーマ技術

はじめに
ハイブリドーマ技術には、細胞融合、マスター細胞培養のプレーティング、抗体スクリーニングが含まれる。最終的な目標は、所望の特異性または機能を有するモノクローナル抗体を産生する単一のハイブリドーマ細胞を同定することである。細胞のクローナリティを達成することは、規制の観点だけでなくプロセス制御の観点からも重要である。最近まで、ハイブリドーマを生産する研究室では、クローナリティを達成するために、ハイブリドーマの培養と限界希釈クローニングという、労力と時間のかかる連続的な方法を追求してきました。
このアプリケーションノートでは、自動化された方法でハイブリドーマ細胞のクローナリティを検証する必要性を取り上げます。ImageXpress® Velosシステムは、単一細胞を含むウェルの同定、およびそれらの細胞から増殖したコロニーの特性解析のために、マルチウェルプレートの高感度、迅速、堅牢なスクリーニングを提供します。
実験
ハイブリドーマ細胞を透明ポリスチレン組織培養プレートで培養した。ハイブリドーマ株、増殖培地、およびヒトIgGの定量はMedarex社(Milpitas, CA)から提供された。ImageXpress Velosシステムは488 nmレーザーで構成された。レーザー散乱シグナルはチャンネル1に集められ、蛍光はチャンネル2の510~540 nmのバンドパスフィルターで濾過された。96ウェルCostar組織培養プレートをImageXpress Velos Systemのプレートネストにセットしてスキャンし、PMTのゲインを含むすべての装置設定は、ImageXpress Velos Systemのメソッドによって自動的に設定された(図1参照)。プレートは通常10μの解像度でスキャンされ、設定時のスキャンタイムは120秒であった。
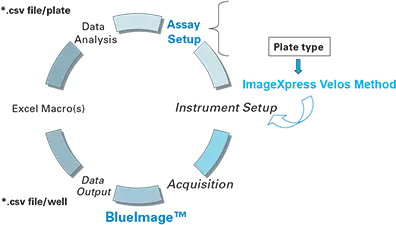
図1. データ収集とデータ解析のフロー図。ImageXpress Velos System Method は、アッセイの種類と特定のプレートに対して定義されたすべての装置パラメーターを制御する。取得したデータは単一ファイルとして、またウェルごとに画像スタック(各パラメーターごとに 1 つの画像)として保存されます。ウェルまたはプレート全体のデータ解析は、BlueImageを使用して事前に定義された「プロセス」を実行し、「オブジェクト」を分類して、ウェルごとに測定されたすべてのパラメータを含むカンマ区切り変数(csv)データファイルを生成します。
ハイブリドーママスター培養
ハイブリドーママスター培養は、0日目の細胞融合後、96ウェルの透明ポリスチレン組織培養プレートで樹立した。6,12,24,48,96ウェルの密度の標準ポリスチレン組織培養プレートを使用できることは以前に証明されている。96ウェルプレートを6、8、11日目にスキャンした。培地の半量交換は7日目に行った。図2に示すように、散乱画像は培養日数に対するハイブリドーマコロニーの成長を明確に示している。無菌状態を維持するため、スキャン中は蓋をしたままにしておいた。
6日目
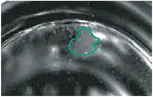
8日目
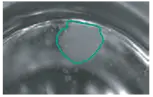
11日目

図2. ハイブリドーママスター培養プレートの単一ウェルのImageXpress Velos System Ch1レーザー散乱画像。プレートは6日目、8日目、11日目に10ミクロンの解像度でスキャンされた。画像はハイブリドーマコロニー(黒で輪郭を描く)の成長を示し、測定面積は6日目、8日目、11日目でそれぞれ0.4、1、3.3 x 106 µ2。プレート側面、蓋、液面(メニスカス)からの複雑なレーザー反射に注意。
組織培養プレート内の単一細胞分析
レーザー散乱で細胞を検出することも可能だが、より確実なアプローチは、細胞を(CMFDA、Molecular Probes社、オレゴン州ユージーン)で染色し、蛍光を測定することである。CMFDAで染色した単一細胞と、その細胞から増殖したコロニーの画像を図3に示す。透明なポリスチレンプレートからのレーザー誘起蛍光(LIF)により、複雑な問題が生じる(注:黒い壁のプレートでは問題にならない)。図3のウェルの右側に見られるこれらのシグナ ルは、画像閾値法を用いて細胞を明確に定義する能力を制限する。しかし、高速フーリエ変換(FFT)を用いて不要なシグナルを除去することで、単一細胞の検出が可能になります。このプロセスの結果を図4に示す。初期画像は、CMFDAで染色された2つの細胞があるウェルを示し、続いてFFTフィルター処理が行われ、最後に閾値処理と単一細胞の測定が行われる。表Iは、この技術を用いて96ウェルプレートに0.5細胞/ウェルをプレーティングし、0日目にウェルあたりカウントされた細胞数を示している。分解能を10µに設定することで、頑健な検出のために細胞あたり十分な数のデータ点が得られ、120秒のスキャンタイムが可能になる。

図3. ウェルFO2内のCMFDAで染色した単一細胞(左の画像;単一細胞を囲む青い円)と、2回目のCMFDAで染色したコロニー(右の画像)のImageXpress Velos System Ch2蛍光画像。ハイブリドーマサブクローニングプレートを0、5、7日目に10ミクロンの解像度でスキャンした。7日目に最終濃度0.5μM CMFDAの新鮮な増殖培地を添加した。7日目は、室温で5分間CMFDAで標識した後のハイブリドーマコロニーの蛍光画像である。右端と左端の他のシグナルは、透明ポリスチレンプレートからのレーザー誘起蛍光(LIF)によるものである。
生画像

FFTフィルター後の画像

閾値処理された粒子
図 4. 2つのCMFDA染色細胞を含む単一ウェルのImageXpress Velos System蛍光画像(「Raw Image」と表示された左の画像における細胞の周りの青い丸)。ハイブリドーマサブクローニングプレートを0日目に10ミクロンの解像度でスキャンした。生画像は、透明ポリスチレンプレートからのLIFによる左端のシグナルを示している。FFT画像処理ステップの後、低空間周波数の信号が除去される(「FFT後の画像」と表示された中央の画像)。その結果、閾値処理された画像("閾値処理粒子 "と表示された右の画像)には、このウェルに2つの細胞が写っている。

表I. 0日目の96ウェルプレート1ウェルあたりの細胞数
ハイブリドーマの成長とコロニー形成にCMFDA標識は影響しない
ハイブリドーマ細胞をCMFDAで繰り返し標識し、スキャンしても、図5の代表的なコロニーで示されるように、細胞の増殖およびコロニー形成能に影響はなかった。さらに、追加の研究により、i) 抗体産生はCMFDA染色に影響されないこと、ii) 抗体検出は単一のCMFDA標識細胞を含むウェルにリンクできることが示された(データは示さず)。
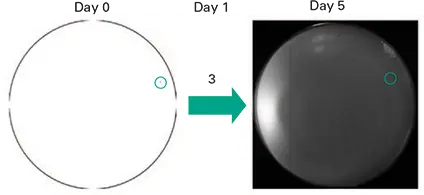
図 5. ImageXpress Velos SystemによるCMFDA染色細胞1個を含むウェルの蛍光画像(Day 0と表示された画像中の細胞を囲む青い点線円)。ハイブリドーマサブクローニングプレートを0日目に10ミクロンの解像度でスキャンした。3日目にウェルを手動で調べたところ、3個の細胞が含まれていた。5日目に得られたコロニーをCMFDAで染色し、スキャンした(右の画像はDay 5と表示)。青い点線の円は、最終的なコロニーを形成した1個の細胞の位置を示している(細胞移動の証拠に注意)。
結論
ImageXpress Velos システムを使用することにより、マルチウェルプレートの多数のウェルから分泌産物をシングルセルレベルcl で迅速に解析することができる。このために重要なことは、完全なウェルをスキャンし、細胞やコロニーのマルチパラメトリー解析を実行できることである。具体的には、以下のような機能を実証した:
- 標準的な組織培養プレートにおけるCMFDA染色細胞の迅速な細胞計数
- ハイスループットで迅速な単一細胞の検出
- コロニーの成長モニタリング
- 生細胞クローン(トランスフェクトーマ)のマルチカラー蛍光分析
単一細胞を含むウェルを迅速に同定する能力は、抗体探索プロセスを加速する可能性を秘めています。この技術は、所望の産物を発現するトランスフェクション細胞の同定だけでなく、分泌産物の検出にも広く応用できる。さらに、このプラットフォームは、分泌産物の量を細胞数に対して正規化する能力を提供する。これらの機能は、高生産性細胞株の選択が重要なステップであるバイオプロセス開発において特に重要である。
PDF版(英語)