Application Note SpectraMax MiniMaxサイトメーターを用いた
Oris Proアッセイによるセル遊走解析
- ウェルあたり1枚の画像からセル遊走を正確に測定
- 大きなシグナルウィンドウでStainFreeまたは蛍光イメージ解析の柔軟性を実現
- SoftMax® Proソフトウェアで遊走細胞を含む関心領域を自動解析
PDF版(英語)
はじめに
ある場所から別の場所への細胞の遊走は、正常な生物 学的プロセスにおいても異常な生物学的プロセス においても重要な要素である。様々な生物学的プロセスにおける細胞遊走の重要性から、細胞遊走を促進(創傷治癒)または抑制(腫瘍形成)する治療成分を同定するために、そのメカニズムを研究するシステムの開発が進められてきた。
本研究では、SpectraMax® i3 マルチモードマイクロプレートリーダーのオプションアップグレードであるSpectraMax® MiniMax™ 300イメージングサイトメーターを用いて、Platypus Technologies社のOris™ Pro Cell Migration Assayを用いた細胞遊走の可視化と解析の実行可能性に焦点を当てます。このアッセイは、無毒性の生体適合性ゲルを使用し、溶解して各ウェルの中央に細胞のない検出ゾーンを形成するため、細胞が検出ゾーンに遊走する際に関与する細胞遊走メカニズムを研究することができます。
材料と方法
セル培養とアッセイ
HT1080細胞を、Oris Pro Cell Migration Assay付属の96ウェル(20,000個/ウェル)または384ウェル(8,000個/ウェル)のコーニング製黒色透明底プレートに播種した。ここではコラーゲン I コーティングバージョン(Platypus Technologies 社のカタログ番号PROCMACC1)を用いた。このアッセイは、無毒性の生体適合性ゲルを用いて、細胞培養表面に無細胞ゾーンを形成する。
播種後、セルを加湿チャンバー(37℃、5% CO2)に約4時間入れて細胞の接着を促した。その後、細胞の遊走を阻害することで知られる細胞透過性マイコトキシンである試験化合物シトカラシンD、または0.1% DMSOビヒクルコントロールを添加した新鮮培地を加えた。
48時間後、プレートをインキュベーターから取り出した。Molecular Devices StainFree™ Cell Detection Technologyを用いた後の解析のために、MiniMaxサイトメーターを用いて各ウェルの透過光画像を取得した。
CellTracker™ Green CMFDA Dye(Thermo cat. # C2925)で細胞を染色し、製造元の指示に従い、MiniMax サイトメーターの緑色蛍光チャンネ ルを使用して蛍光イメージを取得した。画像取得後、蛍光エンドポイント測定(励起472 nm、発光526 nm)を行い、SpectraMax® i3リーダーの蛍光検出モードが細胞遊走の検出に使用できるかどうかを判定した。
マイクロプレートの各ウェルにおけるセル遊走量は、取得した画像の中で、溶解した生体適合性ゲルによって形成された検出ゾーンに対応する関心領域を指定して分析した。次に、SoftMax® Proソフトウェアを使用して、透過光画像における細胞遊走量をStainFreeテクノロジーを用いて算出した。CellTracker Greenで染色した細胞については、SoftMax Proの蛍光強度に基づく細胞検出アルゴリズムを使用した(図1)。
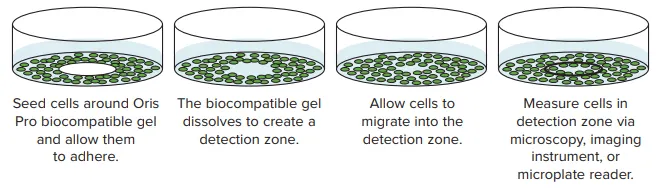
図1. オリスプロ細胞遊走アッセイの概略図。このアッセイでは、無毒性の生体適合性ゲルを用い、ウェル中央に無細胞ゾーンを形成する。細胞播種後、生体適合性ゲルが溶解し、細胞がウェル中央の検出ゾーンに遊走する。MiniMaxサイトメーターで取得した画像では、検出ゾーンに対応する関心領域を指定し、細胞の遊走レベル(細胞で覆われた面積)を解析する。
MiniMax サイトメーターおよび SpectraMax i3 リーダーのパラメーター
細胞の遊走は、MiniMax サイトメーターを用いて、各ウェルの検出ゾーンを表す画像部分を解析することで評価した。96ウェルプレートまたは384ウェルプレートの各ウェルについて、1ウェルあたり1部位または4部位をイメージングした。4部位を撮像した場合、SoftMax® Proソフトウェアは、各ウェルのタイル状の合成画像を自動的に作成した。画像解析に加え、SpectraMax i3 リーダーの蛍光イメー ジモードを用いて、検出領域への細胞の遊走を測定した(表1)。
| SpectraMax i3 – Endpoint | MiniMax cytometer – Imaging | |
|---|---|---|
| Plate types | 96- and 384-wells | 96- and 384-wells |
| Read mode | Fluorescence | Camera |
| Read type | Endpoint with bottom read | Fluorescence or transmitted light |
| Wavelengths/bandwidths |
Ex: 472 nm/15 nm Em: 526 nm/25 nm |
Ex 456/Em 541 or TL channel |
| Reads per well | 1 read, 6 flashes per read | 1 site per well or 4 sites per well |
表1. 細胞遊走アッセイのインストゥルメンテーション設定。
データ解析
MiniMaxサイトメーターでは、各ウェルの中心から1~4カ所を撮像した。SoftMax® Proソフトウェアを用いて、生体適合性ゲルの溶解により形成された無細胞検出ゾーンに対応する画像中の関心領域を指定した。検出ゾーンに遊走したセルは、ソフトウエアによって同定された。結果は、遊走した細胞で覆われた総面積とイメージングした総面積の比率で表した。
SpectraMax i3 リーダーでは、蛍光強度測定は下方測定を行うエンドポイント測定タイプで行った。データは4パラメータカーブフィットを用いてグラフ化され、SoftMax ProソフトウェアによりサイトカラシンD IC50値が算出され報告された。
結果
細胞遊走阻害に対するシトカラシンDの用量依存的効果は、細胞を0.1% DMSOまたは濃度の増加したシトカラシンDに曝露することで測定した。
透過光と蛍光の両方を用いた。CellTracker Greenで染色した細胞イメージングをMiniMaxサイトメーターを用いて取得し、各ウェルにおける細胞遊走のレベルを視覚的に確認した。正確に細胞遊走を測定するために必要な最適な撮像部位数を決定するために、1ウェルあたり1部位または4部位を撮像した。
96ウェルプレートでは、1ウェルあたり1部位(図2)および4部位(図3)取得の両方で、透過光および蛍光イメージにおいて、サイトカラシンDとビヒクルコントロールウェルの間に明確な視覚的差異が認められた。画像を解析したところ、検出領域へのセル遊走レベルに対して、シトカラシンDは濃度依存的に強い効果を示した(図4)。
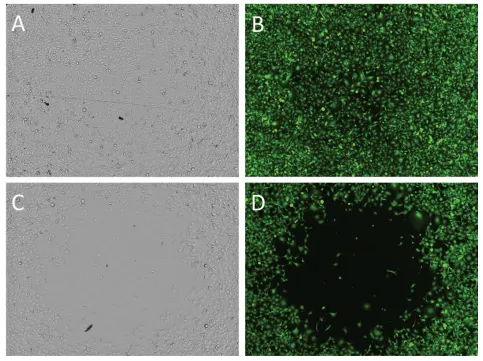
図2. 96ウェルプレートにおける無細胞検出領域への細胞遊走レベルに対して、サイトカラシンDは目に見える抑制効果を示した。透過光(AおよびC)と緑色蛍光(セルトラッカーグリーンで染色した細胞;BおよびD)の両方について、ウェルごとに1カ所をイメージングすることにより、各ウェルの無細胞検出ゾーンを調査した。ウェルは0.1% DMSO(AおよびB)または2μM サイトカラシンD(CおよびD)のいずれかに曝露した。DMSOコントロールに暴露したウェルでは、多くのセルが検出ゾーンに遊走した。2μMのサイトカラシンDでは、検出ゾーンに遊走した細胞はごくわずかであった。
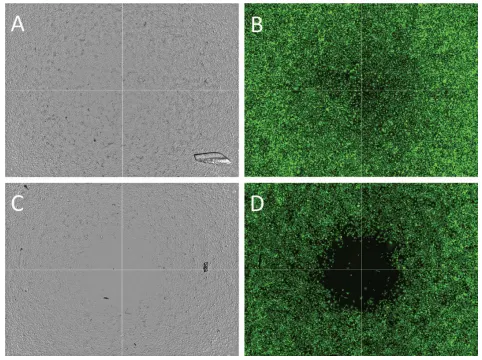
図3. ウェルあたり4部位を用いてイメージングした細胞遊走。透過光(AおよびC)と緑色蛍光チャンネル(セルトラッカーグリーンに染色した細胞;BおよびD)の両方で4つのイメージモンタージュを撮影することにより、各ウェルの無細胞検出領域を調査した。ウェルは0.1% DMSO(AおよびB)または2μM Cytochalasin D(CおよびD)に曝露した。ウェルあたりの1部位のイメージングと同様に、DMSOコントロールは、シトカラシン処理ウェルよりも遊走細胞数がはるかに多いことを示した。
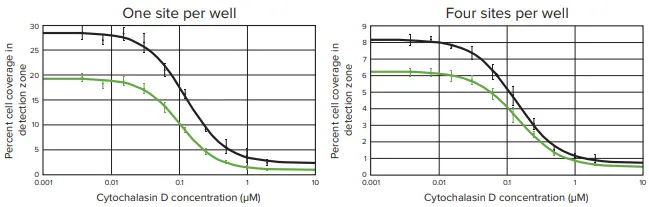
図4. 96ウェルプレートの透過光およびCellTracker Green染色像の両方で、Cytochalasin Dは用量依存的に細胞遊走を阻害した。ウェルを様々な濃度のサイトカラシンDに曝露し、ウェル中心部(ウェルあたり1箇所または4箇所)の透過光画像(黒プロット)またはセルトラッカーグリーン染色画像(緑プロット)のいずれかを解析して、検出ゾーンへの細胞遊走レベルを決定した。検出領域への細胞遊走のレベルは、各ウエル中央の関心領域における細胞で覆われた面積のパーセンテージとして解析した。
次に、ハイスループット環境におけるオリスプロ細胞遊走アッセイの潜在的有効性を判断するために、細胞遊走の阻害に対するサイトカラシンDの用量反応効果を384ウェルプレートでアッセイした。96ウェルプレートのイメージングと同様に、透過光と緑色蛍光チャネルの両イメージにおいて、検出ゾーンへの細胞遊走において、シトカラシンDとDMSOコントロールウェルの間に顕著な差が見られた(画像は示さず)。ウェルあたり1部位と4部位の取得の間に、細胞の遊走における質的な差は見られなかった。画像を解析したところ、検出領域への細胞遊走レベルに対して、シトカラシンDは再び強い濃度依存的効果を示した(図5)。
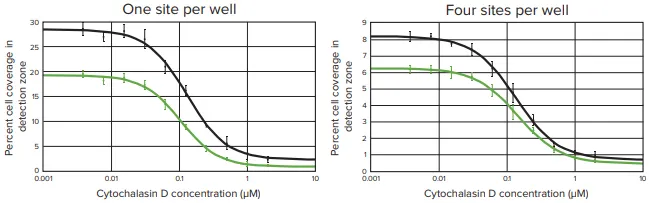
図5. シトカラシンDは、384ウェルプレートからの透過光およびセルトラッカーグリーン染色画像の両方において、用量依存的な細胞遊走阻害を示した。ウェルを様々な濃度のサイトカラシンDに曝露し、ウェル中心部(ウェルあたり1箇所または4箇所)の透過光画像(黒のプロット)またはセルトラッカーグリーン染色画像(緑のプロット)のいずれかを撮影し、検出ゾーンへの細胞遊走のレベルを決定した。検出領域への細胞遊走のレベルは、各ウェル中央の関心領域で細胞が覆う面積のパーセンテージとして解析した。
画像解析に加え、SpectraMax i3 リーダーの蛍光検出モードを用い て、CellTracker Green で染色した細胞の蛍光強度を測定した(図 6)。96ウェルおよび384ウェルプレートフォーマットの両方で、シトカラシンDの濃度を上げると、蛍光強度が有意に減少し、MiniMaxサイトメーターを用いて取得した画像で観察された細胞遊走の減少と並行した。これらの結果から、SpectraMax i3 リーダーは、Oris Pro Cell Migration Assayプレートを用いて細胞遊走を検出するのに十分な感度があることが確認された。SoftMax ProソフトウェアでIC50値とZ'因子を計算し、結果を表2にまとめた。同様の結果が、StainFree細胞分析、蛍光イメージャー分析、および蛍光プレート読み取りでも観察された。
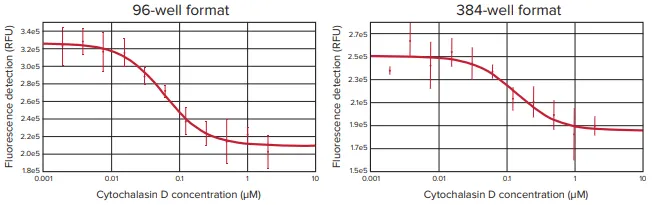
図6. SpectraMax i3 リーダーで測定したところ、CellTracker Green で染色したセルは、シトカ ラシン D の濃度を上げると蛍光が減少した。96ウェルプレート(左)または384ウェルプレート(右)のセルを、濃度の増加するサイトカラシンDに曝露し、エンドポイント測定法を用いてCellTracker Greenの蛍光を測定した。蛍光強度の減少に対するシトカラシンDの用量依存的効果は、細胞遊走に対するシトカラシンDの阻害に対応する。
概要
MiniMaxサイトメーターの透過光および緑色蛍光イメージングの機能を用いて、オリスプロセル遊走アッセイプレートにおいて、サイトカラシンDが細胞遊走を阻害することが明らかに示された。同様の阻害効果は96ウェルと384ウェルの両方のアッセイで見られた。96ウェルおよび384ウェルプレートフォーマットの両方において、細胞遊走に対するサイトカラシンDの阻害効果は、1ウェルあたり1部位でも4部位でも測定することができた。これらの結果は、オリスプロセル遊走アッセイを用いると、1ウェルあたり1枚の画像から細胞遊走を正確に測定できることを示しており、96ウェルプレート全体またはハイスループットの384ウェルプレートフォーマットにおいて、より迅速なデータ取得が可能となる。
シトカラシンDによる細胞遊走阻害は、SpectraMax i3リーダーの蛍光検出モードを用いても測定できたが、標準偏差は画像解析よりも大きかった。これらの結果は、SpectraMax i3 リーダーに搭載された蛍光検出機能を用いて細胞遊走を研究するオプションをユーザーに提供するものである。
SpectraMax i3 Multi-Mode Microplate Detection Platformは、Platypus Technologies社のOris Pro Cell Migration Assayを用いた細胞遊走の研究に理想的である。特許出願中のSpectral Fusion™照明により、SpectraMax i3リーダーは細胞遊走のような要求の厳しいアッセイに対応できる最適な感度と広いシグナル範囲を持つ。このプラットフォームはMiniMaxサイトメータでアップグレードすることができ、StainFreeまたは蛍光イメージャーによる柔軟な解析が可能で、シグナルウィンドウもさらに大きくなる。
| CYTOMETER(MiniMax) | SpectraMax i3 | ||||
|---|---|---|---|---|---|
| 透過光 | 緑色蛍光チャンネル |
エンドポイント測定 Ex. 472 nm Em. 522 nm |
|||
| 1 image/well | 4 images/well |
4 images/well |
4 images/well |
||
| 96 well | 0.130 | 0.138 |
0.139 |
0.147 |
0.060 |
| 384 well | 0.129 | 0.138 |
0.106 |
0.109 |
0.142 |
表2. SpectraMax i3プラットフォームで異なる検出方法によって得られたIC50(nM)値のまとめ。シトカラシンDは、透過光イメージ、緑色蛍光チャンネルイメージ、およびエンドポイント蛍光測定において、同様のIC50値を示している。
SpectraMax i3x マルチモード検出プラットフォームについてさらに詳しく >>
PDF版(英語)