Application Note FLIPR Tetraシステムを用いた
FLIPRカリウムアッセイキットによる
hERGチャネルブロッカーの特性評価
- 細胞ベースアッセイにおけるK +チャネル活性の機能的測定
- ホモジニアス無洗浄プロトコールにより、ウェルとタウエルのばらつきを低減し、ワークフローを簡素化
- 非ホモジニアスアッセイと比較してシグナルウィンドウを拡大
PDF版(英語)
はじめに
ヒトエーテル・ア・ゴーゴー関連遺伝子(hERG)イオンチャネルの薬物誘発性阻害は、致死的な心室頻拍性不整脈であるトルサード・ド・ポアンティーズに対する患者の感受性に関係している。近年、多くのFDA承認薬が、hERGに対するオフターゲット作用のために市場から撤退した。その結果、創薬プロセスの早い段階でhERGチャネルを阻害する化合物を同定する必要性が高まっている。ここでは、FLIPR® Tetraハイスループット・セルラー・スクリーニング・システムを用いた、hERG化合物の活性を調べるための新しいカリウム・アッセイ・キットの有用性について紹介する。このアッセイは、カリウム(K+)チャネルに対するタリウム(Tl+)の透過性を利用したもので、新規の蛍光インジケーター色素によって検出される。細胞ベースアッセイで 7 種類の参照 hERG ブロッカーを調べ、その結果を IonWorks Barracuda® Plus Automated Patch Clamp システムで得られた値と比較した。
材料と方法
FLIPR® Potassium Assay Kit(図1)にはタリウム感受性インジケーター色素が封入されている。最初の色素負荷ステップで、Tl+指示薬はアセトキシメチル(AM)エステルとして細胞膜を通過する受動拡散により細胞内に入ります。細胞質のエステラーゼがAMエステルを切断し、活性のある蛍光原性の形態にする。さらに、バックグラウンド蛍光を減少させるため、特許取得済みマスキング色素が細胞外に適用される。カリウムチャネルを活性化するために、セルはK+とTl+の混合物、またはTl+存在下のリガンドで刺激される。蛍光シグナルの増加は、Tl+がポタシウム・チャネ ルを特異的に介して細胞内に流入したことを表し、したがってポタシ ウム・チャネル活性の機能的測定を意味する。FLIPR Potassium Assay Explorer Kit(Molecular Devices 社のカタログ番号 R8222)には、Tl+ 感受性色素、ホモジニアス操作用マスキング色素、200 mM K2SO4、50 mM Tl2SO4、5X 塩化物フリー緩衝液、HBSS + 20 mM HEPES 緩衝液が封入されています。キットは96、384、または1536ウェルプレート10枚に対応する。アッセイのワークフローを図2に示す。
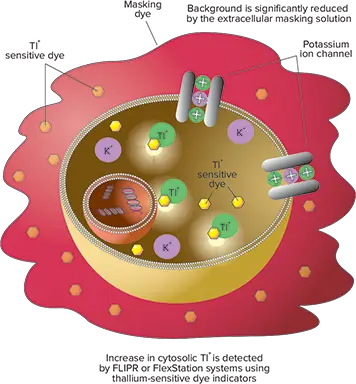
図1. FLIPRカリウム測定キットの原理。

図2:FLIPR TetraシステムでのFLIPRカリウムアッセイキットのワークフロー。
化合物の調製
化合物の疎水性は、おそらく実験器具への非特異的結合を介して、見かけの力価に影響を与える。この研究では、化合物はまず100%DMSOで希釈し、アッセイ直前にガラスライニングしたポリプロピレンプレートでHBSS+20mM HEPESバッファーにミキシングしながら移した。
実験手順
ヒトKv11.1(hERG)イオンチャネルを安定的にトランスフェクトしたチャイニーズハムスター卵巣(CHO)細胞は、ChanTest Corporation(オハイオ州クリーブランド)から提供された。セルは、選択抗生物質を含む増殖培地中で、アッセイの2日前に384ウェルの黒壁クリアボトムプレートに6,500/ウェルでプレーティングされ、37℃、5%CO2でインキュベートされる。アッセイ24時間前に、培地をテトラサイクリンを含む誘導培地に交換する。アッセイの4時間前に、hERGチャネルの膜発現を高めるため、セルを37℃から28℃に切り替える。プレーティングは暗所、室温で色素とともに1時間インキュベートする。
薬理学的分析のために、hERGチャネル遮断化合物を最初に添加し、室温で30分間インキュベートする。FLIPR Tetraシステムでの検出時には、あらかじめ最適化された刺激バッファーがウェルに添加される。470-495 nmの励起LEDと515-575 nmのエミッションフィルターを使用)。比較のため、FluxOR Assay Kit(Life Technologies社製)を用いて並行実験を行った。このキットを使用する際は、メーカーのアッセイプロトコールに従った。データは1秒間隔で約140秒間取得した。データファイルは解析のためにGraphPad Prismにエクスポートされる。
アッセイ開発は、まずhERGチャネルの刺激に必要なタリウムとカリウムの最適濃度を決定することによって行われる。様々な濃度のK2SO4とTl2SO4を含む刺激バッファーをテストするためにプレーティングをセットアップする。硫酸タリウムと硫酸カリウムは1モル当たり2当量の陽イオンを持っているので、それぞれの陽イオン濃度は2倍とみなされる。FLIPR Tetraシステムで検出する間、刺激緩衝液はセルに添加される。シグナルトレースは濃度の組み合わせの中で比較され、最大のシグナルをもたらす最適濃度が決定される。ここでは、hERGに対して最大のシグナルをもたらした最適(最終)Tl+濃度は1 mMであり、最適(最終)K+濃度は10 mMである(図3)。
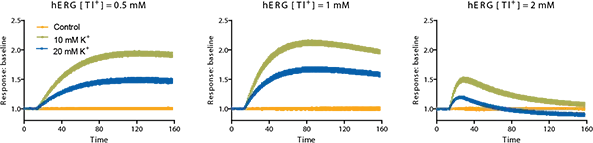
図3:hERGチャネル刺激剤の最適化。セルは色素とともにインキュベートされ、FLIPR Tetraシステムでの検出中に刺激剤バッファーが添加された。様々な条件下で、シグナルの濃度依存的な反応を特徴付けた。最適なシグナルは、1mM Tl+と10mM K+(最終濃度)の刺激剤バッファーを塩化物を含まないバッファーで希釈した組み合わせで得られた。
電気生理学
比較のため、IonWorks Barracuda System1を用いて、同じhERGチャネル遮断薬セットのIC50値を収集した(図4)。周波数依存性の化合物効果を捕捉するため、化合物添加の前後に電圧プロトコルを0.1Hzで5回印加した。5回目の掃引におけるhERGテール電流のピーク振幅が化合物効果の測定に使用される。
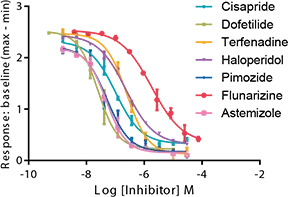
図4. IonWorks Barracudaシステムを用いた電気生理学的アッセイ。化合物は1% DMSO中の最終アッセイ濃度3倍で添加され、0.33% DMSO中の最終化合物濃度が1倍になるようにウェル内のバッファーと混合された。化合物を5分間インキュベートした後、電圧プロトコルを適用し、+40 mVで1秒間の刺激を行い、その後-50 mVまで1秒間のステップでピークテール電流を測定した。
結果
FLIPR Potassium Assay Kitを用いて、7種類の既知のhERG遮断薬を評価した。濃度応答曲線を図5に示す。IonWorks Barracudaシステムで得られたデータと比較したIC50値を表1に示す。2つのアッセイ間で化合物の力価の順位は保たれ、IC50値はHalf-log以内にあり、良好な相関が見られた。
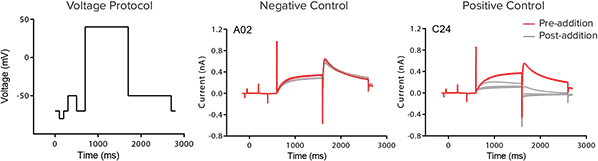
図5. 参考化合物によるhERGチャネルの濃度依存的阻害。
| 化合物 | ClogP | IC 50 (nM) FLIPRテトラシステム |
IC 50 (nM) イオンワークスバラクーダシステム |
比率 |
|---|---|---|---|---|
| ドフェチリド | 25 | 1.4 | 15.3 2 |
1.6 |
| アステミゾール | 48 | 6.1 | 62 | 0.8 |
| ピモジド | 6.4 | 51 | 55 | 1.5 |
| シサプリド | 3.7 | 102 | 69 | 0.9 |
| ハロペリドール | 3.8 | 237 | 81 | 2.9 |
| テルフェナジン | 6.5 | 249 | 332 | 0.8 |
| フルナリジン | 5.4 | 1,795 | 1,000 | 1.8 |
表1. FLIPR Tetraシステムを用いたFLIPRカリウムアッセイキットのIC50値とIonWorks Barracudaシステムを用いた電気生理学的データの比較。
さらに、別のタリウムベースアッセイキットであるFluxORカリウムイオンチャネルアッセイに対する性能を評価するために、3つの化合物を使用した(図6)。表2に示すように、IC50値はアッセイ間で類似している。しかし、FLIPR Potassium Assay Kitが提供するシグナルウィンドウは2.25(反応対ベースラインの比として決定)であり、FluxORの値(0.5)よりも有意に高い。ネガティブコントロールはhERGチャネルの反応をブロッキングする4 µMのテルフェナジンであり、ポジティブコントロールは刺激バッファーに対してhERGチャネルが最大の反応を示すバッファーである。ウェル間の変動が小さく、シグナルウィンドウが大きいため、図7に示すようにZ'ファクターが大きくなる。これは、FLIPRカリウムアッセイキットが洗浄工程や培地交換を必要としない真に均一なアッセイであるため、ウェル間の変動が少ないためと考えられる。
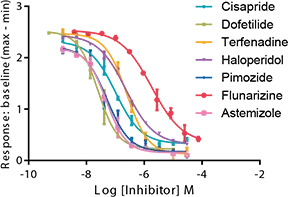
図6. FLIPR Potassium Assay Kitと競合キットの結果の比較。
| 化合物 | IC 50 (nM) FLIPRカリウム測定キット |
IC 50 (nM) FLUXOR キット |
|---|---|---|
| アステミゾール | 60 | 34 |
| ピモジド | 51 | 27 |
| テルフェナジン | 121 | 90 |
表2. FLIPR Potassium Assay Kitと競合キットのIC50値の比較。
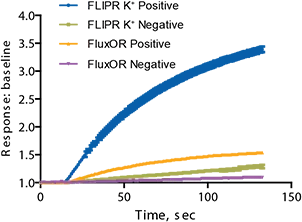
図7. FLIPR Potassium Assay Kitと競合キットのシグナルダイナミックレンジの比較。ネガティブコントロールは4 µMテルフェナジン、ポジティブコントロールはバッファー。FLIPR Potassium測定キットのZ'ファクターは0.85、n=32であったのに対し、競合キットのZ'ファクターは0.64、n=30であった。
結論
FLIPR Potassium Assay Kitは、ホモジニアスで洗浄不要のプロトコルを用いてカリウムチャネルの機能活性を測定します。本研究では、FLIPR Tetraシステムで得られた結果と電気生理学的手法で収集されたデータとの密接な相関性を実証するために、基準となるhERG遮断薬のセットを使用した。
別の実験では、FLIPRカリウムアッセイキットは他社製品と比較して、有意に大きなアッセイウィンドウと高いZ'ファクターを示した。アッセイ品質の向上は、FLIPR Tetraシステムのハイスループット性能と相まって、創薬プロセスの初期段階におけるhERG負債の解析に強力なプラットフォームを提供する。
Molecular Devices社の以下のシステムと互換性があります。

参考文献
- Karen Cook, James L. Costantin, and Xin Jiang, Validation of the IonWorks Barracuda System for hERG Ion Channel Assay, アプリケーションノート, 2011.
- D. Rampe, et al, シサプリド(プロパルシド)の催不整脈作用のメカニズム:ヒト心臓カリウムチャネルHERGの高親和性遮断, FEBS Letters 1997; 417(1): 28-32.
詳細はこちら
PDF版(英語)