Application Note モノクローナル抗体作製に一般的に使用されるCHO細胞株を用いた
従来のクローニング法とCloneSelectシングルセルプリンターf.sightの比較
- 細胞分注プロセスをリアルタイムでイメージングし、品質管理を即座にフィードバック可能
- 2台の独立したインストゥルメンテーション装置から取得した単一細胞イメージングを文書化することにより、高い単クローン性を保証
- 非常に効率的なセルソーティングにより、限界希釈法と比較して5倍以上のクローンアウトグロースの改善
- フローサイトメトリーと比較してソート後の細胞生存率を15倍まで向上させることにより、高感度細胞株の単離を可能に
PDF版(英語)
はじめに
Shan Liu, PhD | Senior Cell Line Development Scientist | Molecular Devices
細胞株開発に関する規制がますます厳しくなるにつれ、 研究者はシングルセルクローニングを実施し、細胞株がシング ルセル細胞由来であることの証拠(クローナリティの証 拠)を提出することが求められるようになるでしょう。
限界希釈法(LD法)とは、プレート中のウェルのごく一部 (10~30%)のみが単一細胞を封じ込めやすいという確率に基 づいたプロセスです。フローサイトメトリー(FC)によるセルソーティングも伝統的なクローニング法の一つで、より高い効率でプレートの各ウェルにシングルセルを注装置することができますが、ソーティング時の高い流体圧がソーティング後の細胞の生存率に無視できない影響を与える可能性があります1-2。さらに、インストゥルメンテーションのメンテナンスやトレーニングにかかるコストが高いため、リソースへのアクセスが限られているユーザーにとっては障壁となっています。費用対効果の高い細胞株開発ワークフローと高効率のクローニング法が求められています。CloneSelect™シングルセルプリンター™f.sight™ (f.sight)は、このようなニーズに応えるように設計されており、細胞成膜の全過程をイメージングし、タイムスタンプを記録しながら、単一細胞をウェルに穏やかに成膜します。
この研究では、6セットの実験を行い、動物性成分を含まない(ACF)細胞培養培地とサプリメントを用いて2つのCHO細胞株のクローニングを行い、f. sightの性能を他の2つの一般的なクローニング法(FCとLD)と比較しました。
材料と方法
細胞株#1は、Thermo Fisher Scientific社から購入した親細胞株FreeStyle™ CHO-S(R80007)、細胞株#2は、組換えヒトIgG分泌CHO DG44細胞株(Molecular Devices社特許取得済み細胞株)。いずれの細胞株も、すべての実験に先立ち、4mM L-グルタミン(25030081、Fisher Scientific)を封じ込めたXP CHO Growth A培地(K8860、Molecular Devices)で少なくとも4継代、解凍・培養しました。
試験した各セル株について、クローニング培地の成分およびサンプル調製のワークフローは同一。クローニング培地は、EX-CELL® CHOクローニング培地(C6366, Sigma SAFC)に4mM L-グルタミンと2.5% ClonaCell™-CHO ACF supplement (3820, STEMCELL)を添加したものを使用。クローニングに先立ち、細胞はクローニング培地中で、対数期に達するまで0.35x106viable cells/mlの播種密度で48時間アダプター培養。クローニング当日、1,000万個の細胞を回収し、1 µM CAM(R8343A, Molecular Devices)で37℃、15分間染色。染色後、細胞をプレーン培地で2回洗浄し、プレーンクローニング培地に懸濁し、30μMセルストレーナーで濾過し、1x106生存クローン/mLの密度に調整した後、後述の3つのクローニング法に適用するため、3つの別々のチューブに分注。
f.サイト法
プレーティングプレートに完全クローニング培地(200 µL/ウェル)をプレフィルド。1x106 個/mL の生きたシングルセル懸濁液60 µLを、使い捨ての滅菌セルカートリッジに装填。細胞カートリッジをCloneSelect Single-Cell Printer f. sightにセットし、細胞サイズ、真円性、蛍光強度などのユーザー定義パラメータに基づいて、5つの標準96ウェルプレート(セルニング3300)に1ウェル当たり1細胞の密度で細胞を注入しました。
FC法
分注の準備ができた染色セルをプレフィルドプレート(200 µL/ウェル)とともに BD FACS Aria™ Fusion ソーターに移しました。蛍光のない/低い染色セルは、蛍光セルソーティングのベースラインリファレンスとして使用しました。細胞をノズル(85 µM、シース圧45 psi)に通し、細胞の蛍光強度に基づいてソーティングし、1ウェルあたり1細胞の密度で96ウェルプレート5枚にプレーティングしました。
LD法
1x106 生細胞/mL の密度で染色したセルを、0.33 生細胞/ウェルの播種密度を目標に 1:1000 希釈(1x103 生細胞/mL)。1:1000希釈液から合計165個の生存細胞(165 µL)を取り出し、100 mLの完全クローン培地を含む培地ボトルに添加。セルをボトルを静かに振り混ぜて混合し、標準96ウェルプレート5枚にウェル当たり200μLずつ移しました。
すべての播種済みプレートは、細胞をプレートの底に沈降させるため、イメージング前に200 gで3分間遠心しました。プレートは、CloneSelect™ Imafer(CSI)システム(透過光のみ)で0日目、1日目、2日目、7日目、14日目にイメージングし、細胞増殖を追跡し、播種から細胞拡大までのクローナリティを確認しました。
単細胞数とコロニー数は、細胞画像を手動で確認することをベースに評価しました。細胞のコンフルエンスは、CSIソフトウェアを用いてウェルごとに自動計算しました(図1)。計数の判定に使用された基準は、6つの実験セットすべてに一貫して適用されました。すべての単細胞事象は、成膜後1日目、2日目、または7日目の細胞増殖を調べることでさらに検証されました。単一細胞のような粒子または生きたシングルセルを封じ込めたセルは、ボイドウェルとしてカウントしました。単細胞がウェルの端に沈着し、クローナリティの確認が困難な場合、そのウェルは研究から除外しました。単細胞堆積効率は、0日目に単細胞を封じ込めたウェルの数÷適格ウェル総数(すなわち、上述の基準で除外されなかった残りのウェル数)で計算しました。アウトグロース効率は、14日目に単細胞由来のコロニー(20個以上の細胞がクラスタリングしている)を封じ込めたウェルの数を、適格ウェルの総数で割って算出しました。
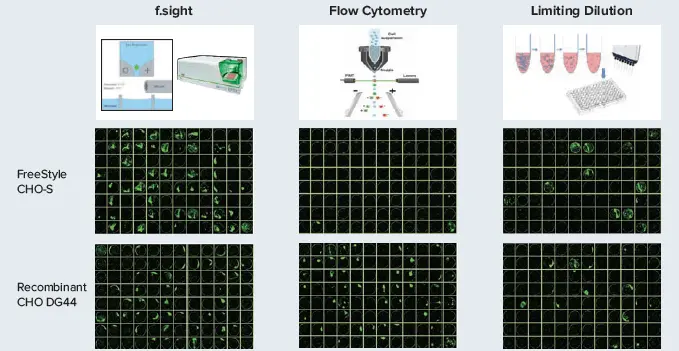
図1. 上のプレート画像は、単細胞培養から14日後の細胞増殖の様子。緑色の擬似着色は、CSI上の明視野で画像化したコロニーのセグメンテーションによるもの。
結果
表1に示すように、シングルセル細胞株やアウトグロースの効率は、細胞株や採用したクローニング法によって大きく異なります。
| Cell type | クローン法 | 対象ウェル | 単細胞ウェル | 多細胞ウェル | 単細胞由来のコロニーを含むセル | 単細胞効率(%) | 成長効率(%) |
|---|---|---|---|---|---|---|---|
| FreeStyleCHO-S | f.sight (SUM) Mean± SD (n=5) |
467 93.4 ± 1.8 |
385 77.0 ± 3.1 |
11 2.2 ± 0.8 |
262 52.4 ±6.0 |
385/467 82.4% ± 3.0% |
262/467 56.1% ± 5.8% |
| FreeStyleCHO-S | FC (SUM) Mean± SD (n=5) |
463 94.6 ± 0.5 |
304 60.8 ± 2.4 |
12 2.4 ± 1.1 |
16 3.2 ± 1.3 |
304/473 64.3% ± 2.8% |
16/473 3.4% ± 1.4% |
| FreeStyleCHO-S | LD (SUM) Mean± SD (n=5) |
467 92.2 ± 2.8 |
61 12.2 ± 2.4 |
17 3.4 ± 1.5 |
45 9.0 ± 2.3 |
61/461 13.2% ± 2.2% |
45/461 9.7% ± 2.3% |
| Recombinant CHO DG44 | f.sight (SUM) Mean± SD (n=5) |
466 93.2 ± 1.3 |
402 80.4 ± 1.8 |
14 2.8 ± 0.8 |
247 49.4 ±7.8 |
402/466 86.3% ± 3.0% |
247/466 53.1% ± 8.8% |
| Recombinant CHO DG44 | FC (SUM) Mean± SD (n=5) |
462 92.4 ± 1.8 |
307 61.4 ± 3.6 |
11 2.2 ± 1.8 |
228 45.6 ± 5.9 |
307/462 66.5% ± 4.1% |
228/462 49.4% ± 6.9% |
| Recombinant CHO DG44 | LD (SUM) Mean± SD (n=5) |
466 93.2 ± 1.9 |
61 12.2 ± 1.3 |
32 6.4 ± 2.7 |
51 10.2 ± 1.3 |
61/466 13.1% ± 1.3% |
51/466 10.9% ± 1.3% |
表1. 3つの異なる方法(f.sight: CloneSelect Single-Cell Printer f.sight; FC: Flow Cytometry; LD: 限界希釈法)。
一般に、FCを用いた平均シングルセル細胞(成膜)効率は、両セル株でf.sightを用いた場合よりも約10~20%低くなりました(FreeStyle CHO-Sではそれぞれ64.3% ±2.8% vs. 82.4% ±3.0%、組み換えCHO DG44ではそれぞれ66.5% ±4.1% vs. 86.3 ±3.0%)(図2A)。CHO DG44細胞はすべての実験において同程度の生存率を示したため、この効率の低下は、FCを使用して寄託後に観察された生存率の低さによるアーチファクトとは考えにくく、単一細胞数の過小評価につながる可能性があります。予想通り、LD法では、試験した3つのクローニング法の中で最も低い単細胞効率が得られました(FreeStyle CHO-Sでは13.2%±2.2%、組換えCHO DG44では13.1%±1.3%)。
FreeStyle CHO-Sセルのf.sightによるアウトグロース効率は、FCのそれよりも最大16.5倍高く、LDのそれよりも5.7倍高い(f.sight vs. FC vs. LD: 56.1% ±5.8% vs.3.4% ±1.4% vs.9.7% ±2.3%)。しかし、組換えCHO DG44セルでは、FCを介したアウトグロースの平均効率はSCPと同程度であり(49.4%±6.9% vs. 53.1%±8.8%)、FCを介したクローニングの効率は細胞株依存性であることが示唆されました(図2B)。組換えCHO DG44細胞のf.sight経由のアウトグロース効率は、LD経由のそれよりも約4.8倍高い(53.1%±8.8%対10.9%±1.3%)。
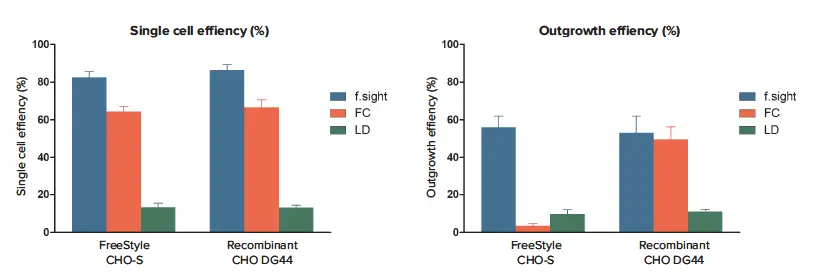
図2. フローサイトメトリー(FC)および限界希釈法(LD)と比較したf.sightの単細胞培養効率およびアウトグロース効率 A: f.sightはFCおよびLDよりも単細胞培養効率で優れていました(f. sight vs. FC vs. LD: 82.4% ±3.0% vs. 64.3% ±2.8% vs. 13.2% ±2.2%)。 f.sight vs. FC vs. LD: 82.4% ±3.0% vs. 64.3% ±2.8% vs. 13.2% ±2.2%, FreeStyle CHO-S, n=5; f.sight vs. FC vs. LD: 86.3 ±3.0% vs. 66.5% ±4.1% vs. 13.1% ±1.3%, recombinant CHO-DG44, n=5). B: f.sightはまた、試験した3つのクローニング法の中で最も高いアウトグロース効率を示した(f.sight vs. FC vs. LD: 56.1% ±5.8% vs. 3.4% ±1.4% vs. 9.7%% ±2.3%、それぞれFreeStyle CHO-S, n=5; f.sight vs. FC vs. LD: 53.1% ±8.8% vs. 49.4% ±6.9% vs. 10.9%±1.3%、それぞれ組換えCHO-DG44, n=5)。
結論
CloneSelect Single-Cell Printer f.sightは、テストした各細胞種にお いて、限界希釈法とフローサイトメトリーによるセルソ ーティングの両方を、クローンアウトグロースの効率で上回 りました。
LDクローニングでは、どちらの細胞タイプでも同等のシングルセルクローンが得られましたが、さらなる特性解析に使用できるクローン細胞全体は、Plateに播種した細胞のわずか10%程度でした。
FC法では、FreeStyle CHO-S細胞では、播種から増殖までの2週間の培養期間中、クローンアウトグロースはほとんど見られませんでしたが、組換えCHO DG44細胞では、f.sight法と同程度のアウトグロース率が得られました。両細胞株は全実験期間を通じて同じ方法で並行して処理されたため、細胞株間でこのようにアウトグロースに大きなばらつきが生じたのは、FC分注プロセス中の高い流体圧(45psi)に関連している可能性が高く、また個々の細胞株の高い流体圧に対する感受性のばらつきが影響している可能性があります2。
f.sightは、細胞株開発のための穏やかで効率的な細胞選別法を提供することで、従来のクローニング法を改善します。このアプローチは、蛍光セルソーティング後の細胞増殖不良につながることが多い、高流動圧に対する耐性が本質的に低い高感度細胞株のシングルセル分離に特に有効です。
参考文献
- Gross A, Schoendube J, Zimmermann S, Steeb M, Zengerle R, Koltay P. Technologies for Single-Cell Isolation. Int J Mol Sci. 2015;16(8):16897–16919
- Mollet M., Godoy-Silva R., Berdugo C., Chalmers J.J.: Computer simulations of the energy dissipation rate in a fluorescence-activated cell sorter: Implications to cells. Biotechnol. Bioeng. 2008;100:260-272
PDF版(英語)