Application Note CatchPoint cAMP蛍光アッセイキットを用いた
完全なcAMPワークフローソリューション
- cAMP検出によるGPCR活性の正確な測定
- アッセイに必要なのは1回の洗浄工程のみ
- 高いシグナル安定性(10分~24時間)
- Z'ファクター0.91
PDF版(英語)
はじめに
本研究では、SpectraMax®i3マルチモード検出プラットフォームと組み合わせたCatchPoint®cAMP蛍光アッセイキットを用いて、アデニル酸シクラーゼの活性化因子であるフォルスコリンに対するHEK293細胞の反応をモニターする方法を示す(図1)
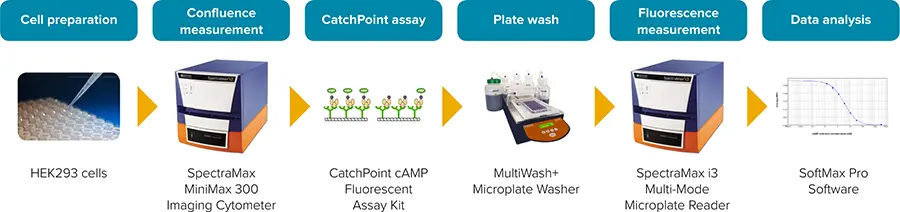
図1:CatchPoint cAMPワークフロー
Gタンパク質共役受容体(GPCR)は、細胞外シグナルを細胞内反応に変換する重要な膜貫通タンパク質である。これらの細胞内応答は、細胞内のタンパク質活性や発現の変化を引き起こす細胞シグナル伝達カスケードで構成される[1]。
環状アデノシン3'、5'-一リン酸(cAMP)は、GPCR活性化の下流で働く二次メッセンジャーである。リガンドがGPCRに結合すると、構造変化が起こり、受容体が活性化され、Gタンパク質が活性化される。さらなるシグナル伝達は、活性化されるGタンパク質の種類によって異なる。Gタンパク質の活性化は、アデニル酸シクラーゼによるcAMPのアップレギュレーションにつながり、プロテインキナーゼAを活性化し、ドーパミンシグナル伝達、糖新生、血管拡張、有糸分裂や卵子の成熟などのプロセスに関与する標的のリン酸化を引き起こす[2-6]。
CatchPoint cAMP FluorescentAssay Kitは、競合免疫測定法を用いてcAMPレベルを測定する(図2)。アッセイに必要なのは1回の洗浄工程のみで、測定は基質添加後わずか10分、あるいは24時間以内に行うことができる。
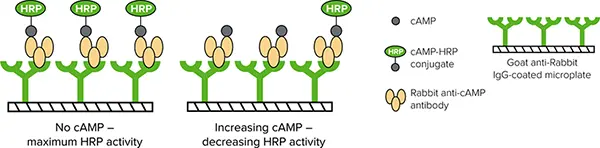
図2:CatchPoint cAMPアッセイメカニズム。細胞で産生された非標識cAMPは、抗cAMP抗体との結合においてcAMP-HRP結合体と競合する。HRP活性の低下により、細胞内cAMP量の増加が検出される。
材料
- CatchPoint cAMP蛍光アッセイキット(Molecular Devices社製 cat. #R8088)
- HEK293細胞 (ATCC cat. #CRL-1573)
- クレブス-リンゲル炭酸水素緩衝液-KRGB緩衝液(Sigma cat.)
- 炭酸水素ナトリウム(Sigma cat.)
◦リン酸緩衝生理食塩水(PBS、Life Technologies社、cat. #10010) - ホスホジエステラーゼ阻害剤、3-イソブチル-1-メチルキサンチン(IBMX、Sigma cat.)
- 3%過酸化水素(H 2 0 2)溶液
- アール塩とL-グルタミンを含む最小必須培地(Corning cat.)
- ウシ胎児血清 (Gemini Bio-Products cat. #100-106)
◦ペニシリン-ストレプトマイシン(Life Technologies cat.)
◦フォルスコリン(Sigma cat.)
◦ポリ-D-リジンコート96ウェルマイクロプレート (Corning cat. #354413)
◦SpectraMax i3 マルチモードマイクロプレートリーダー
◦SpectraMax® MiniMax™ 300イメージングサイトメーター
◦MultiWash+™ マイクロプレートウォッシャー
方法
HEK293細胞を完全増殖培地(MEM+10%FBS+1%Pen/Strep)で培養し、T75フラスコで80-90%コンフルエントになるまで増殖させた。0.05%トリプシンを用いて細胞を回収し、ポリ-D-リジンコートした96ウェル黒壁透明底マイクロプレートの各ウェルに25,000細胞を播種した(25,000~100,000細胞/ウェルが許容範囲)。細胞は5% CO2、37℃のインキュベーターで少なくとも18時間接着させた。
アッセイ当日、SpectraMax MiniMax 300 Imaging CytometerとStainFree™Cell Detection Technologyの透過光チャンネルを用いて細胞コンフルエンスを測定した。細胞コンフルエントが高く、ウェル間のばらつきが少ない細胞の列が、CatchPoint アッセイ用に選択された。細胞を0.75 mM IBMXで室温で10分間予備刺激した。その後、1,000 µMから始まる1:3希釈系列のフォルスコリンで37℃で15分間処理した。その後、CatchPoint assayのプロトコールに従って細胞を溶解した。
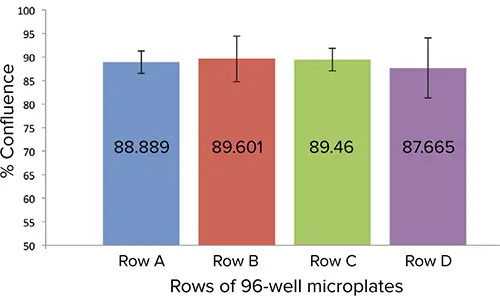
図3:MiniMaxサイトメーターとStainFree解析を用いて測定したHEK293細胞のパーセントコンフルエンス。A列とC列は細胞コンフルエントが類似しており、ウェル間のばらつきが最も小さかったため、アッセイに選択された。
CatchPoint アッセイは、製品添付文書に記載されているとおりに実施した。アッセイ性能を確認し、細胞アッセイサンプル中の cAMP 量を算出するため、cAMP キャリブレーター曲線を作製した。洗浄にはMultiWash+ Microplate Washerを用いました。サンプルは、StopLight Red基質添加30分後にSpectraMax i3 Multi-Mode Microplate Readerで読み取った。すべてのデータ解析とカーブフィッティングはSoftMax®Proソフトウェアで行った。あらかじめ設定されたプロトコールは、ソフトウェアのプロトコールライブラリーで利用可能です。
結果
刺激前の細胞コンフルエンスを評価するため、MiniMaxサイトメーターとStainFreeテクノロジーを用いて、マイクロプレートのウェルにおける細胞カバー率を測定した(図3)。ウェル間のコンフルエンスが一定であったため、A列とC列がアッセイに選ばれた。各処理ウェルから3連サンプルを採取し、アッセイした。
図4と図5は、CatchPoint cAMPキャリブレーター曲線とセルベースアッセイの結果を示しています。どちらの曲線も、SoftMax Proソフトウェ アの4パラメータ曲線フィットを用いて作成した。キャリブレーター曲線のEC50は3.3 nMで、既報のデータ [7]とほぼ一致した。Z'ファクターは0.91であった。
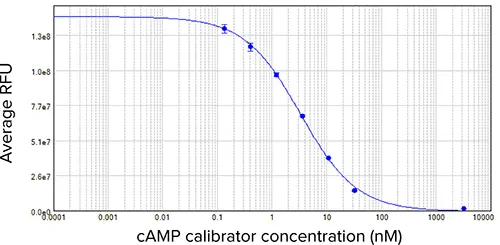
図4:cAMPキャリブレーター曲線。EC50は3.3 nMで、既報の結果と同様であった。サンプルは二重測定した。
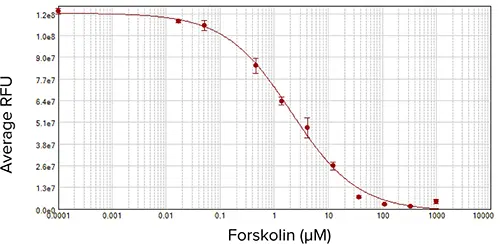
図5:HEK293細胞を用いたセルベースアッセイ。フォルスコリンの濃度反応曲線は、1,000 µMから開始し、3倍希釈系列で、サンプルは重複して実行した。EC50は2.3 µMであった。
フォルスコリンの濃度-反応曲線はEC50が2.3 µMであり、接着フォーマットでアッセイしたHEK293細胞で予想される結果と一致した。
| 注文情報 | ||
|---|---|---|
| 試薬 | 形容 | 品番 |
| CatchPoint cAMP 96-well Explorer Kit | 192 反応 | R8088 |
| CatchPoint cAMP 96-well Bulk Kit | 960 反応 | R8089 |
| CatchPoint cAMP 384-well Explorer Kit | 768 反応 | R8044 |
| CatchPoint cAMP 384-well Bulk Kit | 7680 反応 | R8053 |
結論
CatchPoint cAMP FluorescentAssay Kitは、cAMP検出によるGPCR活性の正確な測定を可能にする。高いシグナル安定性(10 分~24 時間)、優れた Z'ファクター、および蛍光強度検出モードを備えたプレートリーダーでの測定が可能であることから、CatchPoint アッセイはハイスループットスクリーニングのための汎用性の高い選択肢となっています。
以下のMolecular Devicesシステムと互換性があります。

参考文献
- Zaccolo, Manuela. “cAMP signal transduction in the heart: understanding spatial control for the development of novel therapeutic strategies.” British Journal of Pharmacology 158.1 (2009): 50-60.
- Hanoune, Jacques, and Nicole Defer. “Regulation and role of adenylyl cyclase isoforms.” Annual Review of Pharmacology and Toxicology 41.1 (2001): 145-174.
- Griendling, Kathy K., et al. “Modulation of protein kinase activity and gene expression by reactive oxygen species and their role in vascular physiology and pathophysiology.” Arteriosclerosis, Thrombosis, and Vascular Biology 20.10 (2000): 2175-2183.
- Kemp, Bruce E., et al. “Dealing with energy demand: the AMP-activated protein kinase.” Trends in Biochemical Sciences 24.1 (1999): 22-25.
- Etgen, Anne M., Michael A. Ansonoff, and Arnulfo Quesada. “Mechanisms of ovarian steroid regulation of norepinephrine receptor-mediated signal transduction in the hypothalamus: implications for female reproductive physiology.” Hormones and Behavior 40.2 (2001): 169-177.
- Chini, Eduardo N., et al. “Adrenomedullin suppresses mitogenesis in rat mesangial cells via cAMP pathway.” Biochemical and Biophysical Research Communications 215.3 (1995): 868-873.
- Hesley, Jayne, Janet Daijo, and Anne T. Ferguson. “Stable, sensitive, fluorescence-based method for detecting cAMP.” BioTechniques 33.3 (2002): 692-694.
EarlyTox Cardiotoxicity Kitについて詳細はこちら >>
PDF版(英語)