Application Note Axiogenesis Cor.4UヒトiPS細胞由来心筋細胞の拍動における
カルシウム過渡に対する化合物の影響
- 創薬プロセスの早い段階で化合物の毒性と有効性を評価
- 生体関連システムにおける心毒性プロファイルの解析
- スループット要件を満たすためにアッセイサイズを拡張可能
PDF版(英語)
はじめに
心毒性の評価は創薬の初期段階において重要であり、毒性を持つ可能性のある化合物を開発から除外することができる。これは、心臓安全性評価で不合格となった化合物に関連する非効率性と高コストを削減するために極めて重要である。生物学的に適切な細胞ベースモデルを使用し、ハイスループットスクリーニングに適した、予測性の高いin vitro心毒性アッセイの必要性が高まっている。iPS細胞由来の心筋細胞は、遺伝子発現プロファイルだけでなく、ネイティブな心筋細胞に類似した表現型特性を表すため、特に魅力的な細胞モデルである。化合物は心筋細胞におけるカルシウムシグナル振動を阻害することができる。カルシウムシグナルのオシレーションは細胞質カルシウム濃度の変化を反映する。心筋細胞でカルシウム感受性色素を用いると、細胞収縮プロセスの一環として筋小胞体からCa2+が放出されるために細胞質Ca2+濃度が上昇するにつれて蛍光シグナルが増加することが示される。シグナルは、細胞弛緩過程の一部として細胞質から筋小胞体へのCa2+の能動輸送によりCa2+濃度が減少するにつれて減少する。
EarlyTox™ 心毒性キットに含まれるカルシウム感受性色素により、FLIPR® TetraシステムまたはSpectraMax® i3 マルチモードマイクロプレートリーダーを使用して、Axiogenesis Cor.4U® iPS細胞由来心筋細胞におけるカルシウムピーク周波数の濃度依存的変調を評価し、オシレーションパターンを図示することが可能になります。ピーク周波数、振幅、ピーク幅、立ち上がり時間、減衰時間などのパラメーターの変化を同定することで、毒性の可能性を予測したり、医薬品化学や前臨床開発に進む可能性のある化合物を検討対象から除外したりすることができる。さらに、この方法は、心筋細胞に対して治療効果を示す可能性のある化合物の発見や、新しい心臓治療薬のリード物の同定にも利用できる。
材料と方法
EarlyTox心毒性キット(図1)を用いて、iPS細胞由来心筋細胞におけるカルシウムオシレーションに影響を与える4種類の化合物の挙動を評価した。心拍数およびオシレーションパターンは、心筋細胞に対する心毒性作用だけでなく、治療効果を有する可能性のある化合物を同定するために使用することができる。
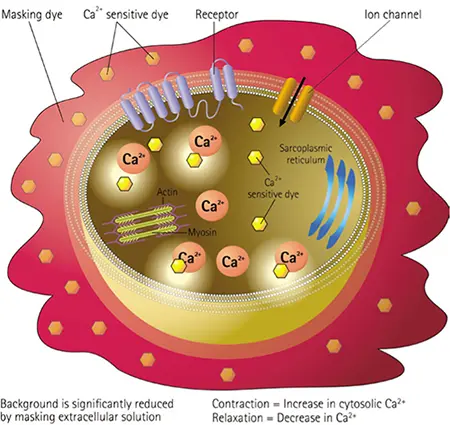
図1. EarlyTox 心毒性キットの測定原理。EarlyTox心毒性キットには、心筋細胞の拍動に伴う細胞質カルシウム濃度の変化を測定するために最適化された新規カルシウム感受性色素と特許取得済みマスキング色素が含まれている。このアッセイキットは、iPS細胞由来の心筋細胞や初代心筋細胞に対する薬理学的化合物の影響を評価するために使用することができる。
このアッセイでは、Axiogenesis, AG, Cologne, Germanyから提供されたヒトCor.4U iPS細胞由来心筋細胞を、フィブロネクチンでコーティングされた黒壁の透明底384ウェルプレートに、1ウェル当たり11,000個の総細胞数でプレーティングした。Cor.4Uプロトコールに従い、細胞を実験の3日前にプレーティングし、5% CO2、37℃でインキュベートした。セルにはCor.4U培地を毎日与えた。
日目までに、細胞は芝生を形成し、ギャップ結合を確立し、同期して拍動していた。アッセイの2時間前、セルは新鮮な培地で培養され、インキュベーターに戻された。色素負荷緩衝液は、EarlyTox Cardiotoxicity Kit色素(Molecular Devices #R8210)を10 mLのCor.4U培養液で希釈して調製し、添加時に心筋細胞の拍動が遅くならないように37℃に加温した。プレート内の25μLの細胞に25μLの色素を添加した。プレートを5% CO2、37℃のインキュベーターに2時間戻した。
色素負荷の間、様々な心臓活性化合物を最終濃度5XのDPBS緩衝液に封じ込めた化合物プレートを作製した。化合物プレートは、細胞への温度の影響を最小にするため、添加前に37℃に加温した。12.5μLの5X化合物を各ウェルに、FLIPR Tetraシステムで検出中にオンラインで、またはSpectraMax i3リーダーで検出前にオフラインで添加した。FLIPR Tetraシステムアッセイでは、化合物添加の3分後に解析用データを収集した。パラメータの計算には ScreenWorks® Peak Pro ソフトウェアを使用し、シグナルトレースと曲線のプロットには GraphPad Prism を使用しました。
ScreenWorks PeakPro ソフトウェア
過渡シグナルデータ解析には、ScreenWorks Peak Proソフトウェアを使用しました。ScreenWorksソフトウェアに追加されたこのモジュールは、拍動細胞からのデータを迅速に解析することを可能にします。ピーク周波数、ピーク回数、不規則な間隔などのパラメータについて、曲線特性を利用できます。さらに、ピーク振幅、ピーク幅(高さ50%時)、ピーク幅(高さ10%時)、間隔、立ち上がり時間、減衰時間の平均値と標準偏差が利用できます。
SpectraMax i3 マルチモードマイクロプレートリーダーでの心筋細胞アッセイ
SpectraMax i3 リーダーで読み取るアッセイでは、化合物は読み取りの 1 時間前にオフラインで添加した。SoftMax® Proソフトウェアを使用して、シグナルトレースの表示、パラメーターの計算、曲線のプロットを行った。
結果
FLIPR Tetraシステムを用いた化合物効果の評価
EarlyTox心毒性色素は心筋細胞のカルシウムシグナル変化を追跡します。細胞拍動中のシグナルトレースでは、細胞収縮プロセスの一環としての筋小胞体からのCa2+放出により細胞質Ca2+濃度が上昇するにつれて蛍光シグナルが増加する。シグナルは、細胞弛緩過程の一部として細胞質から筋小胞体へのCa2+の能動輸送によりCa2+濃度が減少するにつれて減少する。FLIPR Tetraシステムに記録された心筋細胞の拍動に伴う蛍光シグナルの変化の一例を図2に示す。
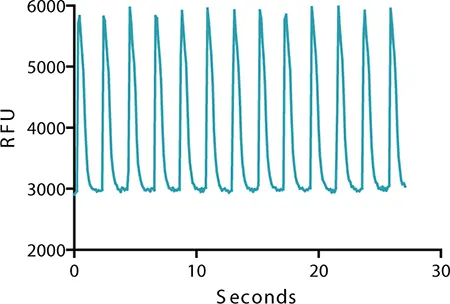
図2:カルシウムシグナルのオシレーション。実験コントロールでは、カルシウムシグナルのオシレーションはCor.4U iPS細胞由来心筋細胞における細胞質カルシウム濃度の変化を反映している。
βアドレナリン作動性GPCRは心筋細胞で見つかっている1 。アゴニストとアンタゴニストは、それぞれ細胞の拍動速度とシグナル特性にプラスまたはマイナスの影響を与える。非特異性アゴニストであるイソプロテレノールの例を図3に示す。拍動パターンと拍動速度の変化が示されている。ウェルあたりに添加するイソプロテレノールの濃度が高くなるにつれて、3分後の時点での拍動数は28から50に増加した。臨床的に不整脈患者に処方されるβアドレナリン拮抗薬であるプロプラノロールは、iPS細胞由来心筋細胞の拍動数を遅くした(図4)。さらに、一過性のカルシウム信号の振幅が減少した。
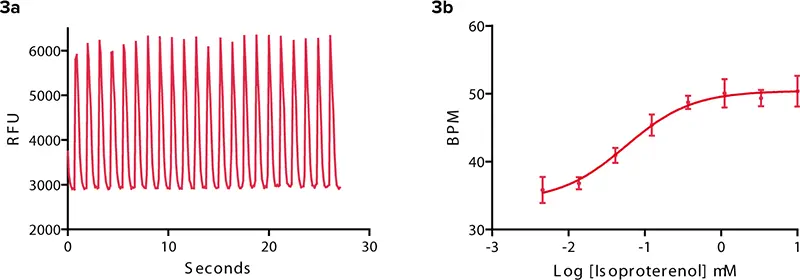
図3:イソプロテレノールβアドレナリン作動薬。(3a) 0.37μMイソプロテレノールに対するカルシウムシグナルのオシレーション。実験対照は図2に示す。 (3b) 化合物添加3分後、イソプロテレノール濃度の増加により、iPS細胞由来心筋細胞の拍動周波数は約36BPMから50BPMに増加する。
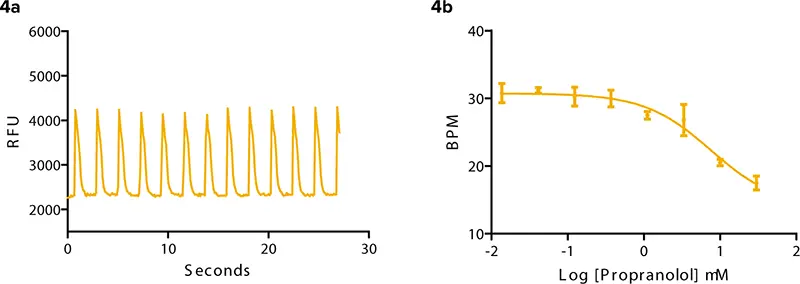
図4:βアドレナリン拮抗薬であるプロプラノロールは、iPS細胞由来心筋細胞の拍動周波数を遅くする。(4a) 3.3μMプロプラノロールに対する拍動パターン。(4b) 化合物添加3分後のBPMは、化合物濃度の増加とともに約31から17に遅くなる。
シサプリドは、以前は胃食道逆流症の治療に使用されていた薬剤である。心臓のhERGチャネルを遮断するhERG遮断薬でもあるため、米国では販売中止となった。この薬は明らかに異なる拍動パターンを示した(図5)。図2のコントロールと比較すると、拍動数は劇的に減少した。さらに、ScreenWorks で計算された 10%振幅でのピーク幅は、図 2 のコントロールと比較して大幅に減少した。
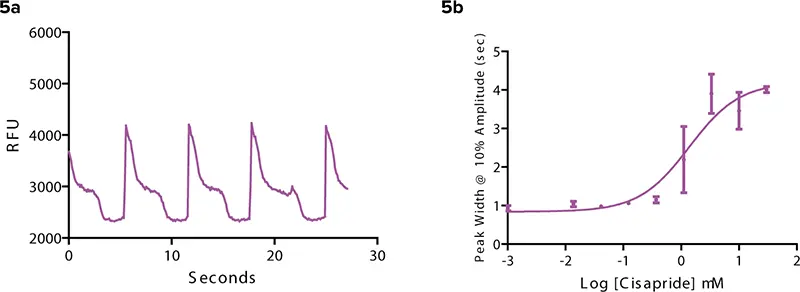
図5. シサプリドはhERG遮断薬である。(5a) シサプリドは、図2の対照と比較して、明らかに異なる拍動パターンを引き起こす。 (5b) シサプリド濃度が増加するにつれて、10%振幅でのピーク幅(秒)が増加する。すべての測定は、化合物添加後3分で行われた。
ピークプロソフトウェアは濃度上昇とともに増加した。hERG遮断薬によるiPS細胞由来心筋細胞の拍動におけるカルシウムシグナルの変化を検出することは、安全性に関連する化合物を早期に同定する上で重要なツールである。
SpectraMax i3 マルチモードマイクロプレートリーダーを用いた化合物効果の評価
別の実験では、Cor.4U iPS細胞由来心筋細胞に色素をロードし、リ ドカインで1時間処理した。リドカインはナトリウムチャネル遮断薬であり、濃度を上げると心筋細胞の拍動速度を遅くする。SpectraMax i3リーダーで、一過性のカルシウムシグナルを40秒間読み取った。細胞の拍動速度を決定するために、各ウ ェルを個別に読み取った(図6)。FLIPR Tetraシステムでのアッセイでは、コントロールウェルのセルはコントロール細胞よりも拍動が遅かったが、それでもリドカインの濃度増加によるBPMの変化を測定することが可能であった。
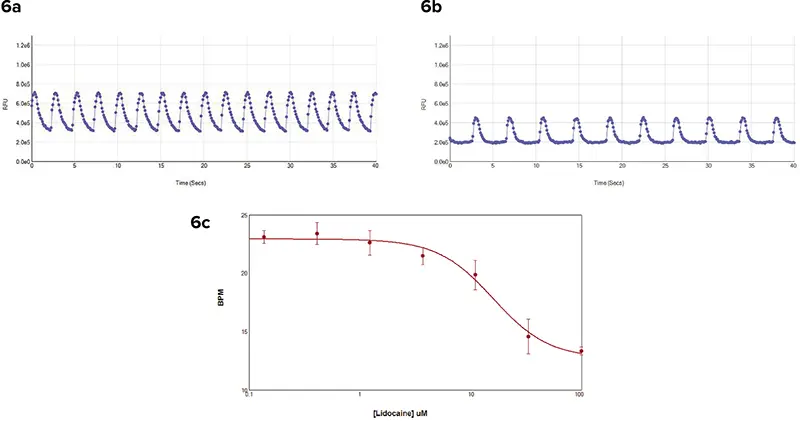
図6. COR.4U iPSC 心筋細胞からのカルシウム過渡シグナル。シグナルは SpectraMax i3 リーダーで読み取った。データ解析はSoftMax® Proソフトウェアを用いて行った。(6a) コントロール細胞のビートパターン。(6b) 処理細胞のビートパターン。(6c) 濃度反応曲線は、細胞がリドカインに1時間暴露されると拍動頻度が減少することを示した。
結論
EarlyTox心毒性キットは、リード最適化の際に化合物の毒性および有効性を予測するための、迅速、簡便、かつ信頼性の高いアッセイ法を提供する。この特許取得済みキットをFLIPR TetraシステムまたはSpectraMax i3リーダーでCor.4U iPS細胞由来心筋細胞と併用することで、研究者は生体関連心毒性アッセイで機能プロファイルを研究し、カルシウムシグナル伝達に対する色素の非特異性影響を最小限に抑え、スループット要件に合わせてアッセイをスケールアップすることができる。
参考文献
- Jaffar, M., et al., The case for induced pluripotent stem cell-derived cardiomyocytes in pharmacological screening, British Journal of Pharmacology (2013) 169: 304-317.
PDF版(英語)