Application Note 自動イメージングを用いて
蛍光ラベルの有無にかかわらず細胞をカウントする
- 蛍光染色または非標識細胞を使用
- 複数の細胞タイプとサイズをカウントする
- アッセイを実施する前に、ピペッティングのアーチファクトや不均一な細胞増殖を特定する
PDF版(英語)
はじめに
ジェイン・ヘスレー|イメージングアプリケーションサイエンティスト|モレキュラーデバイス
マルチウェルマイクロプレート内のセル数を正確に定量する能力は、細胞の健全性や増殖を研究する多くの生物製剤を可能にします。これらのアプリケーションは、蛍光染色された核をイメージングするエンドポイントアッセイを利用する場合もあれば、染色されていない生細胞や固定細胞のロバスト性透過光イメージングを必要とする場合もあります。いずれの場合も、ソフトウェアによるセグメンテーションによるセルの列挙は、迅速かつ信頼性の高いものでなければなりません。ImageXpress® Pico 自動細胞イメージングシステムと CellReporterXpress™ 画像取得・解析ソフトウェアは、標識不要、蛍光染色を問わず、細胞の定量化に最適です。このアプリケーションノートでは、透過光セグメンテーション(解析)アルゴリズムをユーザーが選択することで、多様な細胞タイプの計数精度がどのように向上するかを示し、核染色を使用した場合の結果と比較します。
方法
以下の実験では、いくつかのセルタイプを1:2連続希釈で96ウェルプレートにプレーティングし、一晩増殖させた後、37℃、5% CO2のインキュベーター内で30~60分間、5μM HoechstまたはDRAQ5核染色で標識した。プレーティングはImageXpress Picoシステムで、4倍または10倍のPlan Fluor対物レンズを用い、1視野/ウェルで読み取った。蛍光イメージャーと透過光イメージャーを連続して取得し(透過光が先)、On-the-fly解析で細胞をカウントした。On-the-fly解析は、画像取得中の同時解析を可能にする。

あなたのセルに最適な透過光モジュールをお選びください。
CellReporterXpressには、透過光で細胞をカウントするための3つのモジュールが含まれています。"Transmitted Light Cell Count, General "は、コンフルエント過ぎず、疎ら過ぎないほとんどの細胞単層培養(CHO、Hela、PC-12)に有効です。しかし、図1で報告された実験では、細胞は96ウェルプレートにプレーティングされ、完全にコンフルエントな状態から、1ウェルあたり数細胞しかない状態まで様々でした。対応するTLモジュールは、最も広い範囲の細胞密度で、核染色を用いた定量と最もよく一致する細胞数をもたらした。HepG2のように塊状に増殖する細胞では、高密 度での正確なセグメンテーションが困難な場合があ るため、より正確な結果を得るには、「セル数」ではなく「覆 面積」の測定を使用することが推奨される。
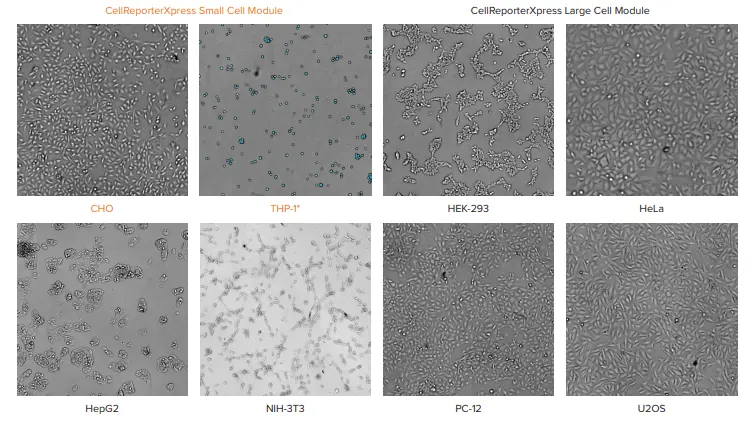
図 1 図 1. 156-20,000細胞/ウェルの異なる細胞タイプの比較は、透過光画像を最も正確にセグメンテーションしたCellReporterXpressソフトウェアモジュールを示している。透過光画像は、10倍の対物レンズを用い、-40 µmのzオフセットで取得した。* THP-1は浮遊細胞。
接着細胞または浮遊細胞のカウント
接着細胞単層または浮遊細胞は、細胞サイズに基づく3種類の透過光(TL)細胞計数分析プロトコルの1つ、または蛍光染色した核を検出するセルカウントモジュールを用いて定量することができた(図2および3)。染色核を用いて検出された細胞と非標識細胞の比較は、過度のコンフルエントでないウェルで一貫していた(図4)。

図2. 蛍光と透過光を用いたHeLa細胞の細胞数の比較。上の画像は、左が10倍の対物レンズで取得した接着細胞(青色核染色)、右が解析結果のマスク(オレンジ色)。下は透過光で撮影した同じ領域(左)、右は解析結果のセグメンテーション(白色)。セル総数は、核カウントでは1710であったのに対し、透過光画像では1790であった。
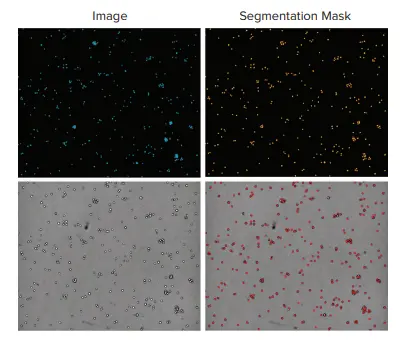
図3. 蛍光と透過光を用いた浮遊細胞の比較。上の画像は、左が10倍の対物レンズで取得したTHP-1白血球(青色核染色)、右が解析結果のマスク(オレンジ色)。下は透過光で撮像した同じ領域(左)と解析結果のセグメンテーション(赤)(右)。セル総数は、核カウントでは325であったのに対し、TL画像では320であった。
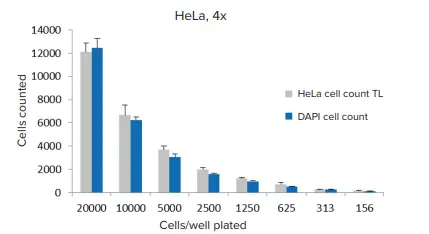
図4. 透過光セグメンテーションとヘキスト染色核を用いた細胞定量の比較。4倍の対物レンズを用いて1ウェル当たり1枚の画像を取得し(n=6ウェル)、CellReporterXpressソフトウェアの設定済みモジュールを用いて解析を行った。
プレート全体のサムネイル画像を使用したピペッティングアーチファクトの検出
透過光(染色されている場合は蛍光)でプレート全体を低倍率でスキャンすることができます。細胞層の不均一性を示すウェルは、CellReporterXpress ソフトウェア(図 5)を用いて目視で確認したり、その場で検出することができます。

図5. プレート全体の低倍率スキャンを用いたプレーティングアーチファクトの同定。(左)Hoechst染色した核のプレートモンタージュビュー。ピペッティングアーチファクトは、4倍で撮影した384ウェルプレートのモンタージュで容易に確認できる。(右)透過光画像(上)はセグメンテーションが可能で、解析結果(下の緑色のマスクオーバーレイ)は、均一な数の細胞を封じ込めなかったウェルを強調表示する。
結論
ress Picoシステムは、付属のCellReporterXpressソフトウェアによるOn-the-fly解析をサポートする論理的なワークフローで、様々な生細胞や固定細胞の定量を可能にします。低倍率スキャン法を使用することで、プレーティングの均一性を即座に品質チェックすることができます。さらに、化合物処理や試薬添加による細胞密度への影響を観察することで、実験結果をより高いレベルで検証することができます。
PDF版(英語)