Application Note 自動細胞イメージングと
生細胞/死細胞アッセイを用いた細胞毒性評価
- 効率的な無洗浄ホモジニアスアッセイプロトコルを使用した細胞生存率の測定
- 生細胞または死細胞を正確に定量化
- 設定済みの解析モジュールにより、統計的に適切な結果を迅速に生成
PDF版(英語)
はじめに
マシュー・ハマー|アプリケーションサイエンティスト|モレキュラー・デバイス
オクサナ・シレンコ博士|Sr.アプリケーションサイエンティスト|モレキュラー・デバイス
ライブ/デッドアッセイは、様々な化合物、治療、遺伝子発現の変化による細胞毒性効果の調査など、様々な研究用途に利用されている。自動化された細胞イメージングと解析は、細胞生存率と細胞死を評価する最適な方法を提供する。ここでは、ImageXpress Pico 自動細胞イメージングシステム CellReporterXpress® 自動画像取得および解析ソフトウェアの使用による、EarlyTox™ Live/Dead Assay Kit で処理した細胞の画像化について説明します。
EarlyTox Live/Dead Assay Kitには、哺乳類の生細胞と死細胞のマーカーが含まれています。生細胞は、カルセインAMにより細胞質内で強い緑色蛍光で染色されます。非蛍光性カルセインAMは無傷の細胞膜を透過し、アセトキシメチル(AM)基が細胞内エステラーゼにより切断され、蛍光性カルセイン分子を生じる。死細胞マーカーであるEthidium homodimer-III(EthD-III)は非蛍光性で、無傷の細胞膜には透過しない。細胞膜の完全性が細胞死に伴って損なわれると、EthD-IIIは細胞内に侵入して核酸と結合し、死細胞で明るい赤色の蛍光を発する。細胞膜の完全性に影響を及ぼす細胞毒性イベントは、この方法を用いて正確に評価できる。このアッセイキットを用いることで、試験化合物の完全な濃度反応プロファイルの特性評価が可能となる。洗浄不要のホモジニアスアッセイにより、死細胞や瀕死細胞を洗い流してしまう洗浄工程が不要となる。カルセインとEthD-IIIの蛍光シグナルを検出し、ImageXpress PicoシステムとCellReporterXpressソフトウェアを用いて、高品質な画像と解析を行うことができます。
材料
- EarlyTox 生死判定アッセイキット
- エクスプローラーキット(2プレートサイズ、Molecular Devices社カタログ番号R8340)
- バルクキット(10プレートサイズ、Molecular Devices cat.)
- HeLa細胞(ATCC P/N CCL-2)
- HeLa培地
- 最小必須培地(グルタミンおよび血清添加完全培地
- スタウロスポリン(Sigma cat.)
- マイトマイシンC(Sigma cat.)
- 384ウェル黒色透明底マイクロプレート(Corning Falcon cat.)
- ImageXpress PicoSystem および CellReporterXpress ソフトウェア
方法
HeLa細胞を5,000細胞/ウェルで黒色384ウェル透明底マイクロプレートにプレーティングし、37℃、5%CO2インキュベーター内で一晩培養した。この細胞を、スタウロスポリン(一般的なタンパク質キナーゼ阻害剤、潜在的な抗がん治療用タンパク質)またはマイトマイシンC(強力なDNA架橋剤、化学療法剤)で、最高濃度の10μMスタウロスポリンと300μMマイトマイシンCから始まる1:3の連続希釈で4重反復して24時間処理した。
化合物処理後、細胞をHoechst 33342核色素(Thermo Fisher Scientific)と組み合わせたLive/Deadアッセイキット試薬で染色した。各ウェルの容量の半分を除去し、カルセインAMとEthD-IIIの2X染色液で置換した。染色の最終濃度は2μM Calcein AMと3μM EthD-IIIであった。その後、Hoechst(最終濃度6μM)を添加する前に、プレーティングを37℃、5% CO2で30分間インキュベートした。細胞を37℃、5% CO2でさらに15分間インキュベートした。最終インキュベーションの直後、プレートをImageXpress Picoシステムで10X Plan Fluor対物レンズを用い、FITC、Texas Red*、DAPIチャンネルでそれぞれCalcein AM、EthD-III、Hoechst色素をイメージングした。この倍率では、1視野で4000~4500個の細胞をイメージングすることができ、統計的に適切な結果が得られる。
* Texas Redが使用できなかったため、元のデータはTRITCフィルターを使用して作成された。Texas RedはLive Deadアプリケーションの推奨フィルターです。
セルスコアリングモジュールを用いた画像解析
画像はCellReporterXpressソフトウェアのCell Scoring解析モジュールを用いて解析した。このモジュールは、生細胞と死細胞を識別し、区別する。Hoechst染色を用いて全細胞を同定し、次に特異性染色であるCalcein AMまたはEthD-IIIについて細胞を陽性または陰性にスコアリングした。図1は、スタウロスポリンで処理した陽性対照と陰性対照、およびスタウロスポリンなしで処理した陽性対照と陰性対照の画像と、陽性細胞と陰性細胞を示す関連解析マスクである。生細胞(Calcein AM陽性)または死細胞(EthD-III陽性細胞)の数とパーセンテージを定義するために、別々の解析を行った。
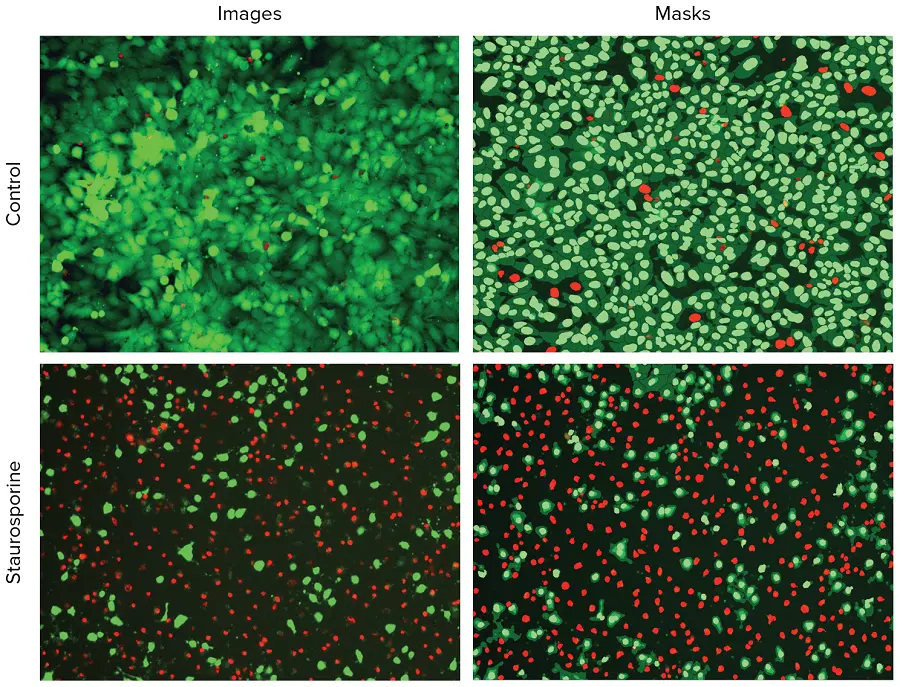
***図1.
陰性対照細胞と0.1μMのスタウロスポリンで処理した細胞の代表的イメージング。左:Hoechst核染色(青)、Calcein AM染色(緑)、EthD-III染色(赤)したHeLa細胞の10倍イメージング。右: 解析マスクは生細胞の核を緑色、死細胞の核を赤色で示す。
用量反応曲線からのEC50毒性計算
生細胞と死細胞を蛍光イメージャーでイメージングし、Calcein AM(緑色蛍光)またはEthD-III(赤色蛍光)陽性染色細胞に基づいて定量的細胞スコアリング解析を行った(図1)。HeLa細胞をスタウロスポリンとマイトマイシンCで処理すると、濃度依存的に死細胞の割合が増加し、生細胞の割合が減少した。図2に示す用量反応曲線は、生細胞の割合対化合物濃度をプロットしたもので、EC50値はスタウロスポリンで0.569μM、マイトマイシンCで223μMであった。
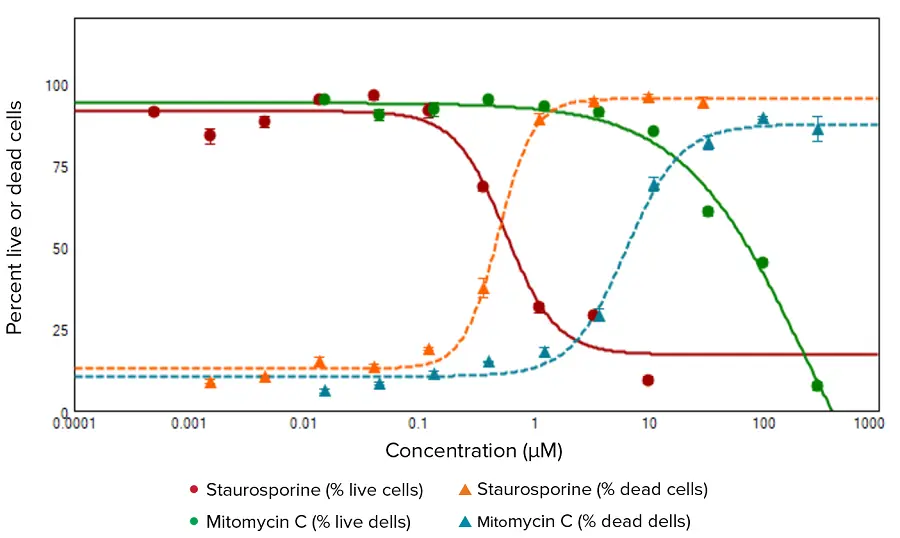
***図2.
異なる濃度のスタウロスポリンまたはマイトマイシンCで処理したHeLa細胞の生細胞と死細胞の割合の濃度依存性。平均値と標準偏差は四重反復から得られた。これらの曲線から得られたEC50値は以下の通りである: 生細胞%については0.569μMスタウロスポリンおよび223μMマイトマイシンC、死細胞%については0.492μMスタウロスポリンおよび6.305μMマイトマイシンC。
結論
EarlyTox Live/Dead Assay Kitは、ImageXpress PicosystemおよびCellReporterXpressソフトウェアと組み合わせることで、簡単で効率的なワークフローで生細胞と死細胞の正確な測定を可能にした。自動イメージングと定量分析により、細胞毒性化合物の試験が可能になり、多くの生物学的アッセイにおける細胞生存率の評価に適している。
PDF版(英語)