Application Note iPSCおよび3Dオルガノイド培養の
ラベルフリーライブモニタリングのための
ディープラーニングベースの画像解析
- 自動ディープラーニングツールで標識不要画像のロスト性画像セグメンテーションを実現
- ディープラーニングのセグメンテーションモデルをカスタマイズし、SINAPを使用して最小限の人的介入で複雑な対象オブジェクトを検出する
- 直感的な機械学習Phenoglyphsツールでデータ分類を簡単に実行
PDF版(英語)
はじめに
Angeline Lim, PhD | Applications Scientist | Molecular Devices
Misha Bashkurov, PhD | Product Owner | Molecular Devices
Oksana Sirenko, PhD | Sr. Scientist | Molecular Devices
オルガノイドや患者由来スフェロイドのような複雑な3Dバイオロジーモデルは、生体内組織をより忠実に再現するため、多くの生物医学研究分野で人気を集めている。これらの3Dモデルは、疾患モデリング、薬剤スクリーニング、毒性研究、宿主と微生物の相互作用、精密医療において大きな可能性を秘めている1。オルガノイドを大規模なスクリーニングに使用するためには、大量のサンプルを処理し、より一貫性があり再現性の高いiPSC株とその由来オルガノイドを培養するための自動化が不可欠である。
自動培養システムの主な要件は、生きた組織をモニターできることである。インキュベーターやイメージャーにアクセスするロボットアームなどの自動化機能を備えたワークセルは、細胞をモニターするための定期的イメージングに使用できる。細胞培養のコンフルエンス、iPSCコロニーのサイズ、オルガノイドのサイズと形状を表す画像から得られる定量的な出力は、細胞の継代やエンドポイントアッセイに進むなど、下流の自動化プロセスのトリガーとなる判断基準として、あるいは品質管理に使用することができる。
細胞をモニターするには、蛍光イメージャーに比べ簡便で光毒性が低い明視野イメージングがよく使われる。しかし、明視野画像はコントラストが低く、バックグラウンドが高いか不均一性で、エッジ効果が出やすい。これらの問題は、解析のためのロバストな画像セグメンテーションを実施する能力を妨げる可能性がある。
機械学習または人工知能(AI)とは、人間の介在の有無にかかわらず、既存データのパターンを識別できる一連の計算アルゴリズムを指す。
ディープラーニングは、人工ニューラルネットワーク(ANN)を使って入出力関係を学習する機械学習の一形態である。ANNは、「ニューロン」または計算セルの多層によって表される数学モデルである5。
近年、画像解析における人工知能(AI)の採用は、多くの研究分野で急速に勢いを増している。AIの一種であるディープラーニングは、医学、病理学、生物学の画像アプリケーションで成功裏に使用されている。従来の画像解析では、下流の定量化のために、対象オブジェクトをセグメンテーションするための固定パラメーターセットを定義することが一般的であった。しかし、これらの事前定義されたパラメータは、実験条件のばらつきが大きいため、すべての実験で機能するわけではない。また、ハイスループット環境では画像データが膨大になるため、解析プロトコルを手動で調整することは現実的ではない。
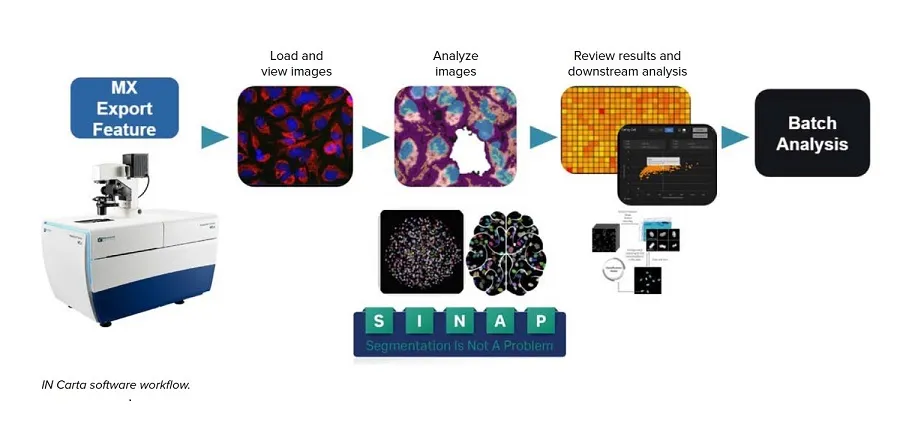
これらの課題を克服するために、画像セグメンテーション(SINAP)と対物レンズ分類(Phenoglyphs)のためのAIツールを用いて、iPSCコロニー、オルガノイド、スフェロイドの画像解析を自動化した。IN Carta®画像解析ソフトウェアは、画像解析ワークフローにAIツールを組み込んだ直感的なユーザーインターフェースを提供します。ディープラーニングベースのSINAPにより、複雑な対象オブジェクト(幹細胞コロニーやオルガノイドなど)を最小限の人的介入でロバスト性に検出することができます。解析出力には、形態学的、強度、テクスチャー測定が含まれる。データの分類は、機械学習ベースのPhenoglyphsを使用することもできる。我々は、3つの複雑な細胞モデル(iPSCの膨張、3D肺オルガノイドの発達、腫瘍組織に対する抗がん剤の効果)に対して、AIベースの対物レンズ検出と表現型の特徴付けを使用することの実現可能性を実証した。これらの結果は、あらゆるハイコンテント自動ワークフローへのディープラーニング画像解析手法の統合を支持するものであり、下流アプリケーションのための高品質iPS細胞およびオルガノイドの大量作製を大いに促進するものである。
材料と方法
画像取得と解析
すべての画像は、ImageXpress® Micro Confocal High-Content Imaging System(Molecular Devices)でMetaXpress®ハイコンテント画像取得・解析ソフトウェアを用いて取得した。iPSCコロニーは比較的平坦で、明視野ではほとんどコントラストを示さないため、コロニー端のコントラストを高めるために、約100μmオフセットして画像を取得した。肺オルガノイドのZ-スタック画像は、4X対物レンズで "best focus "プロジェクション選択で取得した。スフェロイドのZ-スタック画像取得には10X対物レンズを用い、"best focus "プロジェクション画像を選択した。
全ての解析にはIN Carta™ソフトウェアを使用した。IN Cartaソフトウェアへの画像のインポートには、MetaXpress®ソフトウェアの "export to IN Carta "機能を使用した。すべての画像のセグメンテーションにはSINAPを使用した。各モデルは解析プロトコルに使用する前にトレーニングされ、検証された。解析後、クラシファイアツールを使用して、特異性に基づいたグループを作成した。より複雑なデータセットの場合は、機械学習ベースのPhenoglyphを使用して表現型クラスを作成した。
セル培養
肺オルガノイド: 初代ヒト肺上皮細胞(ScienCell)から3D肺オルガノイドを得た。セルはScienCellのプロトコールに従って2Dで培養、増殖させた。3Dオルガノイド培養には、PneumaCult™気道オルガノイドキット(STEMCELL Technologies)をメーカーのプロトコールに従って使用した。簡単に説明すると、細胞を24ウェルプレートフォーマットの90%マトリゲル(コーニング社製)ドームに播種し(ウェルあたり1ドーム)、PneumaCult気道オルガノイド播種培地を用いて2週間、2日おきに給餌した。分化はPneumaCult Airway Organoid分化培地を用いてさらに6週間行った。
iPSC培養: フィーダーフリー条件に適応させたヒトiPSC細胞(SC102A-1、System Biosciences)を解凍し、マトリゲルコートプレート(cat. #354277、Corning)中、Complete mTeSRTM Plus培地(STEMCELL Technologies)で培養した。培地は毎日交換した。ただし、週に一度、培地交換を省略するために2倍量の培地を加えた。細胞は、酵素フリー試薬ReLeSR™(STEMCELL Technologies社製)を用いて、1:6-1:10の分割比で継代した。
スフェロイド培養: 原発性腫瘍由来のTU-BcX4IC細胞からスフェロイドを形成した。これらの細胞は、TNBCサブタイプを持つ準形成乳がんと分類される。TU-BcX-4IC細胞を384ウェルULAプレート(コーニング社製)に1ウェル当たり2000~4000個プレーティングし、72時間インキュベートした。その後、スフェロイドを化合物で処理し、1日目、3日目、5日目にモニターした。
結果
ディープラーニングベースの画像セグメンテーションモデル
自動画像解析は、ほとんどの自動化イメージング・プラットフォームに不可欠な部分である。細胞やオルガノイドをリアルタイムでモニターし、意味のある情報を抽出する能力は、ラベルフリー透過光イメージのロスト性画像解析に依存している。明視野画像の解析に伴う課題には、低コントラスト、高バックグラウンド、イメージングアーチファクトなどがある(図1A)。明視野で撮像された対物レンズのセグメンテーションにおいて、定義されたグローバルパラメータのセットが成功することはほとんどない。最近の機械学習の進歩により、画像解析のワークフローが改善され、複雑なデータセットでもよりロスト性の高い画像セグメンテーションが可能になりつつある。ここでは、幹細胞生物学、3Dオルガノイド、スフェロイドなど、さまざまな生物学的モデルの解析にディープラーニングモデルがどのように使用できるかを示す。
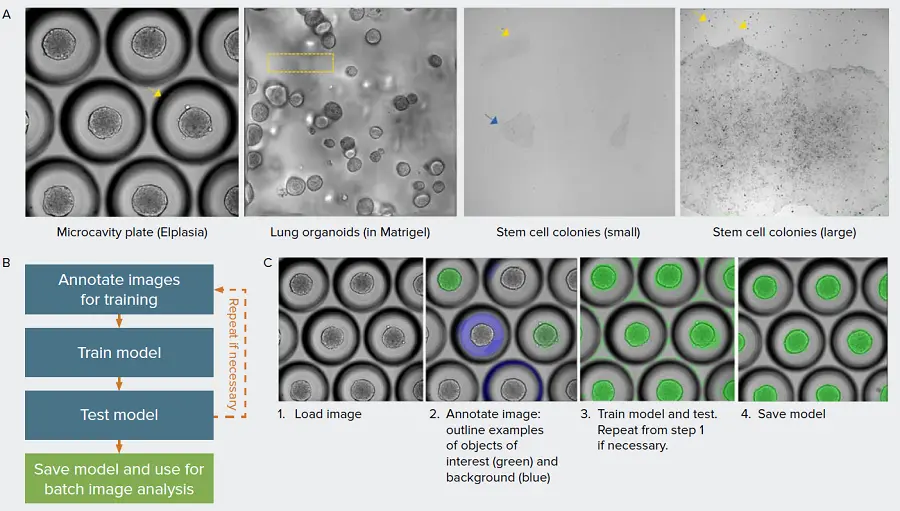
図1. 機械学習ベースのモデルで画像セグメンテーションの課題を克服する。A) 定量解析が困難なさまざまな生物製剤モデルの例。マイクロキャビティプレートで培養された3Dスフェロイドは、各マイクロキャビティの周囲に影が生じ、対物レンズのセグメンテーションを妨げる(矢印)。3Dオルガノイドはマトリゲル中で培養されるが、マトリゲルドームや撮像平面の外側の対物による歪みのため、ホモジニアスでない背景が生じることが多い(ボックス)。 iPSCは比較的平坦な培養物として成長するが、その結果、コントラストが低く(青矢印)、残骸(黄矢印)が生じるため、iPSCコロニーのロバストな画像セグメンテーションが妨げられる。B) モデルトレーニングワークフローの概要。C) SINAPを用いてIN Carta™ソフトウェアでモデルを作成する主なステップ。対象オブジェクトと背景を示すために、ラベリングツールを用いて画像に注釈を付ける。アノテーションされた画像はグランドトゥルース(真実の根拠)となり、トレーニングセットに追加されます。学習ステップでは、最も適した既存のモデルとユーザが指定したアノテーションに基づいてモデルが作成される。この例では、セグメンテーションマスクを修正する必要があり(ステップ3)、ステップ1~3を繰り返す。
iPSC培養の経時的成長モニタリング
iPSC 培養には、毎日の給餌と、自然分化をチェックするため のセル形態の頻繁な目視検査が必要です。培養の継代はコロニーのサイズと分布によって決まるため、iPSC培養の成長をモニターすることは重要である。ここでは、明視野イメージングと機械学習ベースの画像セグメンテーションを用いた解析により、個々のiPSCコロニーの大きさを培養6日間にわたってモニターしている(図2)。
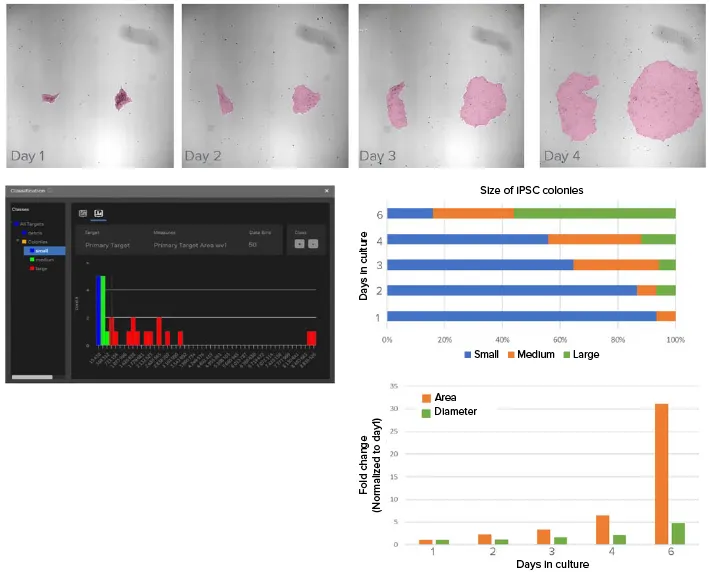
2. iPSCコロニーの分割と成長のモニタリングに使用したディープラーニングベースのモデル。A) 4日間にわたる培養中のiPSCの成長を示す画像例。ピンクのオーバーレイはSINAPによるセグメンテーションマスク。約12枚の画像がアノテーションされ、SINAPのディープラーニングモデルの学習に使用された。B) IN™ソフトウェアの分類ツールを使用して、ユーザーが選択した測定値とゲートに基づいて、セグメンテーションされた対物レンズを分類する。ここでは、対物レンズはその面積に応じて、小、中、大のクラスに分類される。C) iPSCコロニーサイズの経時的分布を示すグラフ。予想通り、培養時間の経過とともに大きなiPSCコロニーの頻度が増加している。D) 培養時間の経過に伴うiPSCコロニーの平均面積と直径の変化(正規化値)。
3D肺オルガノイドの解析
3Dオルガノイドは多くの生物医学的応用が可能な強力なモデルである。オルガノイドはどのような患者からも得ることができるため、創薬や個別化治療において大きな可能性を秘めている。オルガノイドは数ヶ月間培養することができるため、オルガノイドの状態をモニターする能力は、品質管理やタイムラプス研究にとってインストゥルメンテーションとなる。
ここでは、マトリゲルドーム内で培養し、明視野で経時的に画像化した肺オルガノイドの例を示す(図3)。面積、直径、形状係数、テクスチャー、強度などの測定は、オルガノイドの成長と分化をモニターするために使用できる。
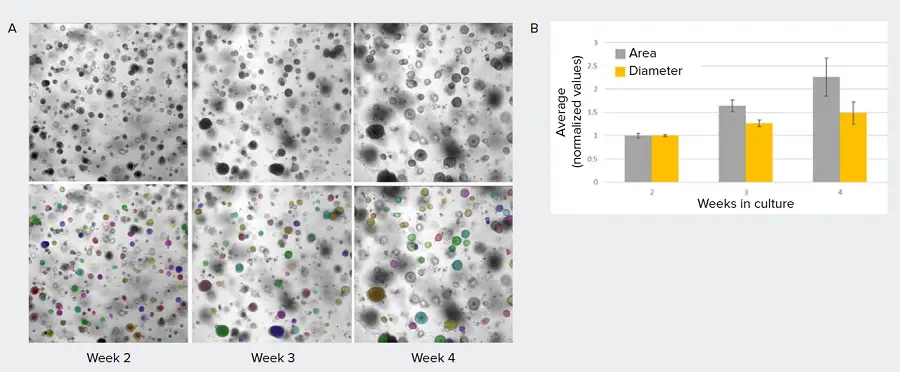
図3. AIを用いた肺オルガノイドの成長評価。A) マトリゲルドーム内で増殖した肺オルガノイドの画像。これらの画像は通常、背景が高く均一性がないため、従来の画像解析手法ではロバスト性の高い対物セグメンテーションができない。SINAPを用いて、肺オルガノイドをセグメンテーションするためのモデルが作成された(色付きオーバーレイで示されたマスク)。B) 培養2、3、4週間における肺の平均直径と平均面積の変化を示すグラフ(正規化、エラーバーは複製ウェル間の標準偏差を表す)。
患者由来腫瘍スフェロイドのセグメンテーションと化合物処理の分類
患者由来腫瘍スフェロイドは、精密医療や創薬において治療化合物を同定するために利用できる可能性がある。トリプルネガティブ乳がんサブタイプを有する原発腫瘍由来のセルを培養し、抗がん化合物で処理した3。スフェロイドの処理効果を経時的にモニターした(図4)。さらに、明視野画像ベースでは、複数のスフェロイド表現型が観察された。未処理のスフェロイドはエッジがはっきりした密な構造を示すが、処理したスフェロイドはエッジが不定形で「拡散」しており、その程度は様々である。IN Carta™Phenoglyphsソフトウェアモジュールは、機械学習に基づく分類のためのツールであり、スフェロイドの形態、強度、テクスチャーに基づく表現型クラスターを同定するために使用することができる。このアプローチは、将来のスクリーニングにおいて複合効果を迅速に同定するために使用できる可能性がある。
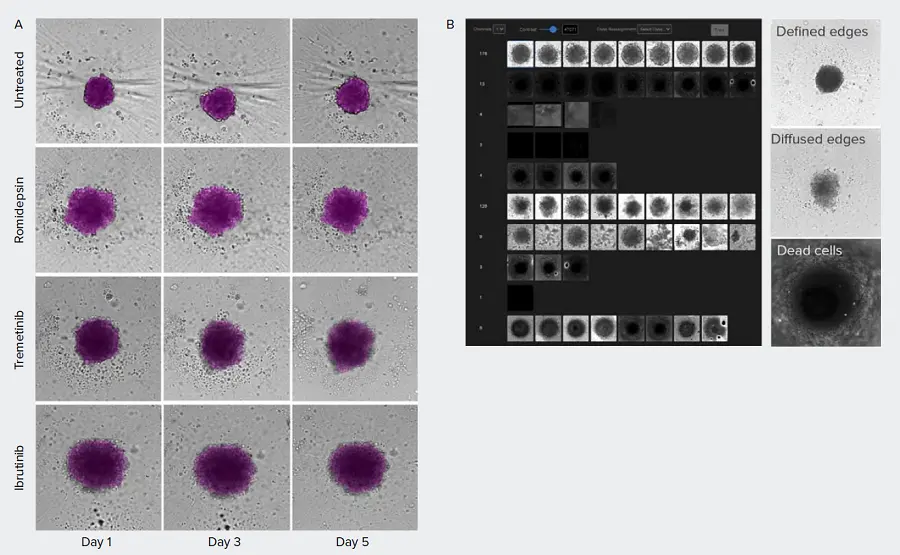
図4. 患者由来スフェロイドに対する化合物処理の経時的形態分析。A) 治療後1、3、5日目に明視野イメージングを用いてスフェロイドをモニターした。画像はIN Carta™ソフトウェアのSINAPを用いてセグメンテーションした(マゼンタのオーバーレイ)。B) IN Carta™Phenoglyphsソフトウェアモジュールを用いて異なる表現型を検出した。未処理のコントロールスフェロイドは、エッジがはっきりした、ぎっしり詰まったセルを示すが、処理したスフェロイドは様々な表現型を示す。処理したスフェロイドのエッジはあまりはっきりせず、エッジが拡散しており、細胞はゆるく詰まっている。
結論
- 複雑な画像やデータセットの解析においてAIを活用したアプローチは、ハイコンテントイメージングワークフローにロバスト性をもたらす。
- SINAPは、標識不要の生物モデルのロバストなセグメンテーションのためのカスタムディープラーニングモデルを作成するためのユーザーフレンドリーなツールである。
- Phenoglyphsは、直感的な機械学習ベースの表現型プロファイルを可能にし、患者由来のスフェロイドなどの複雑なデータセットに適用できます。
- SINAPとPhenoglyphsは、IN™ソフトウェアの補完的なAIツールであり、複雑な生物学的疑問とAI主導の回答とのギャップを埋めるエンドツーエンドソリューションを提供します。
参考文献
- Clevers H. Organoidによる発生と疾患のモデル化。セル。2016;165(7):1586-97.
- Meijering E. A bird's-eye view of deep learning in bioimage analysis. Comput Struct Biotechnol J. 2020;18:2312-2325. doi:10.1016/j.csbj.2020.08.003.
- Chang TC, Matossian MD, Elliott S, et al. 新しい患者由来腫瘍の前臨床モデルを複数派生させたメタプラスティック乳癌における脱アセチル化酵素阻害の評価。PLoS One. 2020;15(10):e0226464.
- doi:10.1371/journal.pone.0226464.
細胞画像解析における機械学習の応用。Immunology and Cell Biology. 2017; 95: 525-530. - Midtvedt B, Helgadottir S, Argun A, et al. ディープラーニングによる定量的デジタル顕微鏡法。Applied Physics Reviews. 19 February 2021, DOI: 10.1063/5.0034891
PDF版(英語)