Application Note SpectraMax i3 マルチモードマイクロプレートリーダーでの
デルフィア細胞増殖アッセイ
- ウェルあたり〜34細胞までの細胞を高感度に検出
- 30年以上の細胞密度の広いダイナミックレンジ
- SoftMax Proソフトウェアで設定済みのプロトコル
PDF版(英語)
はじめに
細胞増殖は、細胞集団に対する化合物の毒性やサイトカインの影響を調べる際に測定すべき重要なパラメータです。細胞増殖にはDNAの合成が必要であるため、細胞増殖を正確に測定する方法の一つは、修飾チミジンヌクレオチドBrdU1 の取り込みをモニターすることです。DELFIA®細胞増殖アッセイは、増殖細胞の新しく合成されたDNA鎖へのBrdUの取り込みに基づく時間分解免疫測定法である。
BrdUはマイクロプレート中で培養された細胞に添加され、そこで増殖細胞のDNAに取り込まれる。取り込まれたBrdUは、ユーロピウム標識モノクローナル抗体を用いて検出される。細胞を固定し、DNAを変性させる。その後、結合していない抗体を洗浄し、DELFIAインデューサー試薬を加え、ユーロピウムを標識抗体から溶液中に解離させ、蛍光性の高いキレートを形成させる。蛍光は、各ウェルの細胞集団におけるDNA合成量に比例する。時間分解検出により、バックグラウンド蛍光や化合物による干渉が最小化され、他の蛍光ベースの細胞増殖法よりも感度が高くなります。
このアプリケーションノートでは、SpectraMax® i3 Multi-Mode Microplate Readerを使用して、HeLa細胞における化学療法薬パクリタキセルとエトポシドの細胞毒性を評価するためにDELFIA細胞増殖アッセイを使用しました。
材料
- DELFIA Cell Proliferation Assay Kit(パーキンエルマー社製 cat.)
- HeLa細胞株(ATCC cat.)
- HeLa用完全培地
- FBS(Gemini Bio-Productsのcat. #100-106)
- ペニシリン-ストレプトマイシン (Thermo Fisher Scientific cat. #15070-063)
- 1x MEM (Corning 社 cat. #10-009-CV)
- 96ウェル、クリアボトム、組織培養処理済みマイクロプレート (Corning cat. #3904)
- SpectraMax i3 マルチモードマイクロプレートリーダー - SpectraMax 時間分解蛍光(TRF)検出カートリッジ(Molecular Devices 社、型番:#0200-7008)
方法
90%コンフルエントに増殖したHeLa細胞をトリプシン処理し、数を数え、96ウェルクリアボトム組織培養マイクロプレート(黒)に1ウェルあたり10,000細胞ずつ播種した。細胞を一晩接着させ増殖させた後、パクリタキセルまたはエトポシドの連続希釈液で48時間処理した。DELFIA細胞増殖アッセイは以下に記述するように行った。詳細については、キットのテクニカルデータシートを参照されたい2。
DELFIA細胞増殖アッセイのダイナミック・レンジを決定するため、HeLa細胞をウェル当たり11~75,000細胞の密度で播種した。細胞播種後直ちに標識溶液を添加し、以下に述べるようにアッセイを行った。
試薬の調製
- 100μMのBrdU標識溶液は、BrdU標識試薬を滅菌培地で1:100に希釈して調製した。得られた溶液は遮光した。- 100 μg/mL の原液を Assay Buffer で 1:200 に希釈し、0.5 μg/mL の抗 BrdU-Eu 作用液を調製した。- 洗浄濃縮液を蒸留水で 25 倍に希釈し、洗浄液とした。
アッセイ手順
- 細胞を100μM標識試薬の1/10量、例えば200μLの培地で培養した場合は20μLで標識し、37℃のインキュベーターで24時間インキュベートした。- ウェルから標識試薬を除去し、100μLのFix Solutionを各ウェルに添加した。プレートを室温で30分間、オービタルシェーカー( \~100-120 rpm)でインキュベートした。- Fix Solutionをウェルから十分に除去した。0.5 μg/mL抗BrdU-Euワーキング溶液100μLを各ウェルに添加し、プレートをオービタルシェーカーで室温、60分間インキュベートした。- 抗BrdU作業溶液を除去し、ウェルを1ウェルあたり300μLの洗浄液で手動洗浄した。200μLのDELFIA Inducerを各ウェルに添加した。- プレートを室温で15分間、オービタルシェーカーでインキュベートした後、ユーロピウム蛍光発光を測定した。
SpectraMax i3リーダーの最適化された設定(表1)を用いてアッセイを検出した。結果は、SoftMax® Proソフトウェアであらかじめ設定されたプロトコルを用いて解析し、グラフ化した。
| パラメーター | 設定 |
|---|---|
|
光学構成 |
TRF検出カートリッジ |
|
読み取りモード |
TRF |
|
読み取りタイプ |
エンドポイント |
|
波長 |
Ex 370 nm Em 616 nm |
|
PMTと光学系 |
パルス数:100 励起時間: 0.05 ms 測定遅延 0.25 ms 積分時間:0.4 ms 読み取り高さ:2.36 mm |
表1. DELFIA細胞増殖アッセイの装置設定。検出カートリッジには励起光源と光学系が含まれています。最適化されたPMTおよび光学系の設定は、キットのテクニカルデータシートに記載されている値とは若干異なり、SpectraMax i3リーダー用に最適化されたものです。
結果
化学療法薬パクリタキセルとエトポシドで処理したHeLa細胞は、文献で報告されたものと同程度のIC50値を示した(図1)3,4。パクリタキセル(タキソール)のIC50値は1.4 nMであったが、トポイソメラーゼII阻害剤であるエトポシドのIC50値は0.81 μMと、はるかに強力ではなかった。DELFIA細胞増殖アッセイのダイナミックレンジは約30.5十年であった。無細胞のアッセイブランクを含めることで、ウェルあたり約34細胞という検出下限値を算出することができた(図2)。
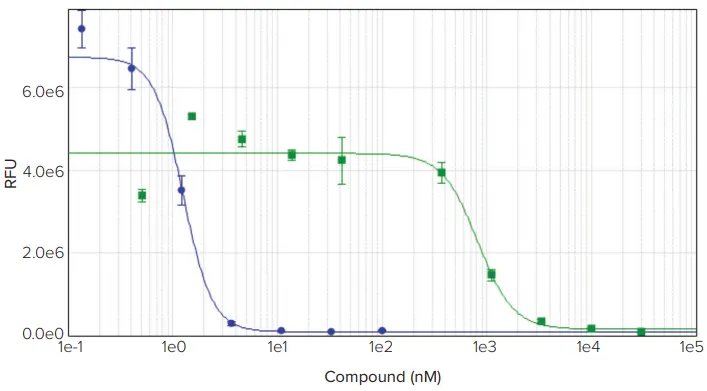
図1. HeLa細胞をパクリタキセル(青丸)またはエトポシド(緑四角)で48時間処理した。パクリタキセル、IC50 = 1.4 nM;エトポシド、IC50 = 0.81 μM。IC50値はSoftMax Proソフトウェアで計算した。
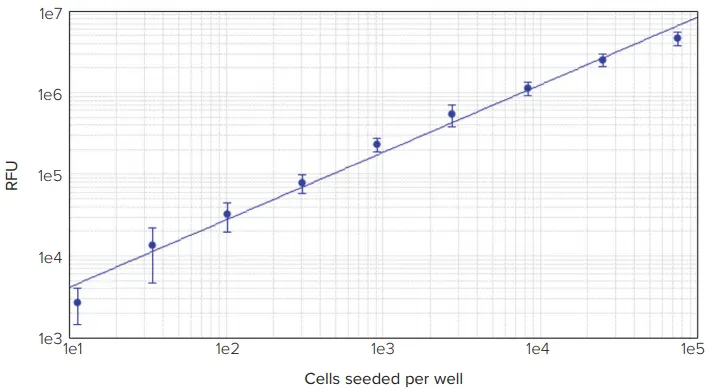
図2. アッセイのダイナミックレンジは、細胞の連続希釈をカウントすることで評価した。上に示したように、直線範囲は75,000細胞からウェル当たり約34細胞までであった(R2 = 0.99、n = 8)。
結論
上記の結果に示されるように、DELFIA細胞増殖アッセイとSpectraMax i3リーダーを組み合わせると、研究者は細胞増殖を測定するための非常に高感度な検査を行うことができる。このアッセイは、図1に示すように、化合物の毒性を正確に調べることができる。アッセイのダイナミック・レンジは約30.5十年で、1ウェルあたり約34細胞まで高感度に検出できるため、さまざまな細胞密度や実験処理条件下で使用できる汎用性の高いアッセイである。
参考文献
1. Gratzner HG. 1982. 5-ブロモ-および5-ヨードデオキシウリジンに対するモノクローナル抗体: DNA複製検出のための新しい試薬。Science Oct 29; 218(4571): 474-5. 2. 技術データシート: DELFIA Research Reagents、細胞増殖キット。3. Liebmann JEら、1993年。ヒト腫瘍細胞株におけるパクリタキセル(タキソール)の細胞毒性研究。British J. Cancer 68.6: 1104. 4. Lock RB and Stribinskiene L. 1996年。ヒト上皮性腫瘍細胞におけるエトポシドによって誘導される二重の死様式は、Bcl-2がクローン形成生存に影響を与えることなくアポトーシスを阻害することを可能にする。Cancer Research 56: 4006-4012.
SpectraMax i3x マルチモード検出プラットフォームについてさらに詳しく >>
PDF版(英語)