Application Note FlexStation 3 マイクロプレートリーダーで
デュアルルシフェラーゼ 発現を検出する
- カラム分注と同時検出によるアッセイのスループットの向上
- ウェルあたりわずか10細胞でホタルとレニラのルシフェラーゼ発現を検出
- 合理化されたアッセイセットアップと迅速な結果のための設定済みプロトコル
PDF版(英語)
はじめに
ホアン・ハー|アプリケーション・サイエンティスト|モレキュラー・デバイス
レポーター遺伝子アッセイは、細胞経路の活性化に関連した遺伝子発現を研究するための重要なツールである。細胞はレポーター遺伝子と目的の配列(典型的にはプロモーターまたは他の転写制御エレメント)を含むプラスミドでトランスフェクトされる。プロモーターが活性化されると、レポーター遺伝子が発現し、そのレベルを測定することができる。
ホタルルシフェラーゼは広く使われているレポーター遺伝子である。その発光シグナルは、蛍光や他の方法に比べて絶妙な感度を提供する。第二の発光レポーターであるレニラ・ルシフェラーゼは、トランスフェクション効率や細胞数などの変動要因を正規化するために、構成的プロモーターの制御下でしばしば使用される。ホタルルシフェラーゼとレニラルシフェラーゼは異なる基質を使用するため、デュアルルシフェラーゼ検出アッセイを使用すると、同じウェルで両方を測定することができます。
SpectraMax® DuoLuc Reporter Assay Kitは、マイクロプレートフォーマットでホタルとレニラの両方のルシフェラーゼを高感度に定量できます。サンプルウェルにホタルの作用液を添加するとホタルの発光反応が開始し、その後レニラの作用液を添加するとホタルが消光すると同時にレニラの反応が開始します。
FlexStation® 3 Multi-Mode Microplate Readerは、SpectraMax DuoLucassayを96および384ウェルフォーマットで高感度、高スループットで実行するために使用できます。FlexStation 3リーダーでは、試薬のピペッティング と発光検出が同時にオンボードで行われ、一連の 反応全体がリアルタイムでモニターされます(図1)
材料
- FlexStation 3マルチモードマイクロプレートリーダー (Molecular Devices社、型番:Flex3)
FlexStation 3 8チャンネルピペッターヘッド(Molecular Devices社、型番0200-6182)
FlexStation 3 16チャンネルピペッターヘッド(Molecular Devices社、型番#0200-6183)
96ウェル黒色FlexStationピペットチップ(Molecular Devices社、型番#0900-0911)
384ウェル黒色FlexStationピペットチップ(Molecular Devices社、型番#9000-0764) - SpectraMax DuoLuc ReporterAssay Kit(Molecular Devices社のカタログ番号R8361)
- HeLa細胞 (ATCC cat. #CCL-2)
- pGL4.13[luc2/SV40] ホタルルシフェラーゼ発現ベクター (Promega cat. #E668A)
- pGL4.75[hRluc/CMV]レニラルシフェラーゼ発現ベクター (Promega cat. #E693A)
- ViaFect™ Transfection Reagent (プロメガ社、商品番号E4981)
- Opti-MEM 還元血清培地 (ThermoFisher Scientific cat. #31985062)
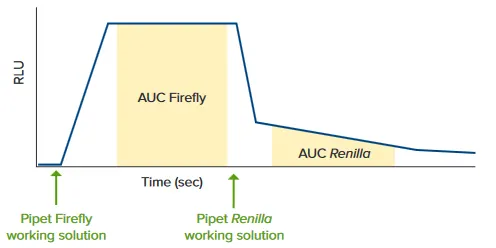
図 1. 反応は、試薬の添加が起こるとリアルタイムで FlexStation 3リーダーでモニターされる。反応の各相の指定部分(ホタルおよびレニラ
)の曲線下面積(AUC)がソフトウェアで計算されます。
方法
細胞トランフェクション
HeLa細胞を6ウェル組織培養処理プレートに1ウェルあたり2x105細胞で播種し、トランスフェクションの前に37℃/5% CO2で24時間インキュベートした。pGL4.13[luc2/SV40]ホタルルシフェラーゼ発現ベクターをOptiMEM培地で1μg/μLに希釈し、pGL4.75[hRluc/CMV]レニラルシフェラーゼ発現ベクターを100ng/μLに希釈した。3本のチューブを以下のようにセットし、穏やかに混合した: 400μLのOpti-MEM培地+2μL(2μg)のpGL4.13[luc2/SV40]ホタルルシフェラーゼ発現ベクター+2μL(2ng)のpGL4.75[hRluc/CMV]レニラルシフェラーゼ発現ベクター。各チューブに6μLのViaFect試薬を加え、内容物を穏やかに混合した。チューブを室温で10分間インキュベートし、トランスフェクション複合体を形成させた。200µLの複合体を6ウェルプレートの各ウェルに滴下し、穏やかに振り混ぜた。細胞を48時間インキュベーターに戻し、処理とアッセイを行った。
細胞溶解物の調製
6ウェルプレートにトランスフェクトした細胞をトリプシン処理し、1ウェルあたり10アリコートに分け、1500rpmで5分間ペレット化し、PBSで1回洗浄した。PBSを除去し、細胞ペレットをアッセイ時まで-80℃で保存した。
アッセイ準備のため、Passive Lysis Bufferと細胞ペレットを室温に温め、各細胞ペレットを150μLのPassive Lysis Bufferで溶解した。細胞溶解は室温で15分間行った。その後、溶解液を Passive Lysis Buffer で 1:2 に連続希釈し、ウェルあたり 4~8700 個の細胞からなる標準曲線を作成した。各濃度の細胞溶解液20 µLを96ウェルプレートの3連ウェルに、各濃度の細胞溶解液10 µLを384ウェルプレートの4連ウェルにピペッティングした。
ルシフェラーゼアッセイのセットアップ
キットの全成分を室温まで解凍した。2.2mgの凍結乾燥基質を含むバイアルに220μLの水を加え、ホタル基質を再構成した。Aquaphile™ Coelenterazineは、440 µgの凍結乾燥基質を含むバイアルに220 µLの水を加えて再構成した。
| Parameter | 96-well | 384-well |
|---|---|---|
| Read mode | Luminescence | |
| Read type | Flex | |
| Wavelengths | All | |
| Integration time | 200 ms | |
| Timing | 2 minutes | 3 minutes 40 seconds |
| Interval time | 3.4 seconds | 5.2 seconds |
| Timing | 2 minutes | 3 minutes 40 seconds |
|
1 st compound transfer |
Add 100 µL of firefly solution Height=50 µL Addition rate=4 Addition time=20 seconds |
Add 25 µL of firefly solution Height=25 µL Addition rate=4 Addition time=20 seconds |
|
2 nd compound transfer |
Add 100 µL of Renilla solution Height=150 µL Addition rate=4 Addition time=60 seconds |
Add 100 µL of Renilla solution Height=75 µL Addition rate=4 Addition time=70 seconds |
| Trituration |
After 1 st compound transfer: Height=50 µL Cycle=2 Volume=50 µL After 2nd compound transfer Height=100 µL |
After 1 st compound transfer: Height=25 µL Cycle=2 Volume=25 µL After 2nd compound transfer Height=25 µL |
| Data reduction |
Firefly: 20 – 67 seconds Renilla : 68 – 120 seconds |
Firefly: 20 – 80 seconds Renilla : 80 – 220 seconds |
表1. FlexStation 3 マイクロプレートリーダー化合物添加およびアッセイパラメーター
***図 2. FlexStation 3 マイクロプレートリーダー用 SoftMax Pro 7 ソフトウェアのユーザーインターフェース。
ソフトウェアのわかりやすいインターフェイスにより、チップと化合物カラムの割り当てが簡素化されます。
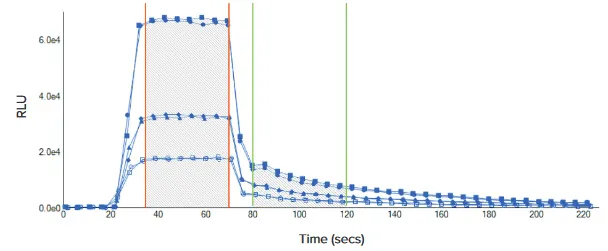
***図3. DuoLuc キネティックトレース。
DuoLucレポーターアッセイからの発光シグナルを経時的に記録し、動態トレースを作成した。上に示したのは、384ウェルマイクロプレートフォーマットでアッセイした3つの異なる濃度の細胞である。ホタル(35-70秒)とレニラ(80-120秒)の曲線下面積
(80-120秒)領域の曲線下面積を上に示した。試薬の移動は20秒と70秒に起こった。
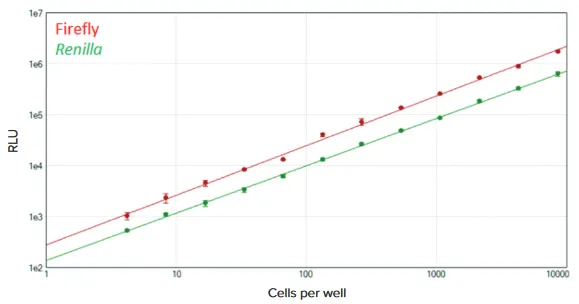
***図 4. 96ウェルフォーマットでのDuoLucレポーターアッセイ FlexStation 3マイクロプレートリーダーを用いて96ウェルプレートで DuoLucレポーターアッセイを行った。ホタル(赤)とレニラ(緑)の標準曲線は、SoftMax Pro Softwareの対数-対数曲線フィットを用いてプロットした(それぞれr2> 0.998)。各希釈について3反復実施した。
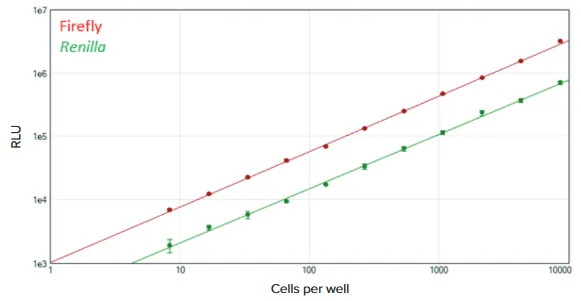
***図5. 384ウェルフォーマットで行ったDuoLucレポーターアッセイ。
SpectraMax DuoLucレポーターアッセイを384ウェルプレートで行った。ホタル(赤)とレニラ
(緑)標準曲線は、SoftMax Pro Softwareのloglog曲線フィットを用いてプロットした(それぞれr2 > 0.998)。各希釈について4反復を行った。
ホタル作業溶液は、ホタル基質をホタルアッセイバッファーで1:50に希釈して調製した。Renilla working solution は Aquaphile coelenterazine を Renilla Assay Buffer で 1:50 に希釈して調製した。96ウェルプレート1枚につき、220μLのそれぞれの基質を加えて11mLの作業溶液を作製した。
SoftMax® Proソフトウェアであらかじめ設定したプロトコルを、表1に示すパラメーターで使用した。ソフトウェアのグラフィカルインターフェースにより、化合物添加のセットアップが容易になりました(図2)。FlexStation 3 マイクロプレートリーダーは、プレートのカラム 全体に試薬をピペッティングし、Flex リードタイプ を用いてこれらのウェルを決められた時間繰り返し読 み取ることができます。各サンプルについてリアルタイムのキネティッ クトレースが生成されます。各キネティッ クトレース内で、ホタルシグナルとレニラシグナルが区別され、そ れぞれについて曲線下面積が計算される(図3)
結果
SpectraMax DuoLucReporterアッセイとFlexStation 3マイクロプレートリーダーを用いて、トランスフェクトしたHeLa細胞中のホタルおよびレニラ・ルシフェラーゼを測定した。96ウェルフォーマットでのアッセイは、優れた直線性と感度を示した。ウェル当たり8700細胞から約4細胞まで、ホタルとレニラの両方の発光を検出することができた(図4)。
アッセイ性能は384ウェルフォーマットでも同等で、同程度の直線性を示し、ウェルあたり約8細胞まで検出できた(図5)
結論
SpectraMax DuoLucreporter アッセイは、FlexStation 3 マイクロプレートリーダーに内蔵されたフルイディクスとルミネッセンス検出を組み合わせると、哺乳類細胞における遺伝子発現を正確に測定する高感度フラッシュ型ルミネッセンスアッセイとなります。このリーダーはまた、プレートのカラム全体に試薬を分注し、選択した総実験時間の間、カラムのウェルを繰り返し読み取ることができるため、デュアルインジェクターベースのシステムよりも高いアッセイスループットを提供する。SoftMax Pro Softwareの直感的なインターフェースと設定済みのプロトコールにより、ユーザーはデュアルルシフェラーゼのセットアップ、測定、結果の解析を迅速に行うことができる。
PDF版(英語)