Application Note PyroGeneリコンビナントC因子アッセイによるエンドトキシンの検出
- シングル酵素ステップと動物由来製品を使用しないエンドトキシンアッセイでサンプルの安全性を確保
- SpectraMaxリーダーで最小要件を超える感度を達成
- SoftMax® Proソフトウェアのワークフローにより、読み取り-インキュベート-読み取りシーケンスを自動化して時間を節約
PDF版(英語)
はじめに
キャロライン・カルドネル|Sr.アプリケーションサイエンティスト|モレキュラー・デバイス
医薬品・医療機器業界では、製造プロセスにおいてサンプルの汚染物質のモニタリングは非常に重要なステップです。グラム陰性菌の細胞壁に含まれるエンドトキシンは、発熱、炎症、頭痛、吐き気、さらには死に至ることもある、頻度の高い汚染物質です。エンドトキシンは、カブトガニ(Limulus polyphemus)の血液を主な試薬とする細胞溶解液(Limulus amebocyte lysate:LAL)アッセイによって日常的に検出されます。エンドトキシンの存在下では、LALは酵素を介したカスケードを介して凝固し、比濁アッセイまたは発色アッセイを用いて定量することができます(図1A)。これらの方法は複数の酵素ステップを含み、カブトガニの入手可能性に依存します。
Lonza社のPyroGene™Recombinant Factor C (rFC) Assayは、単一の酵素ステップで動作し、動物由来の製品を使用せず、LAL法と同じ感度を提供する定量アッセイです。エンドトキシンの存在下で、活性化された rFC は発蛍光基質を切断し、存在するエンドトキシンの量に比例した蛍光シグナル(図 1B)の増加を引き起こします。
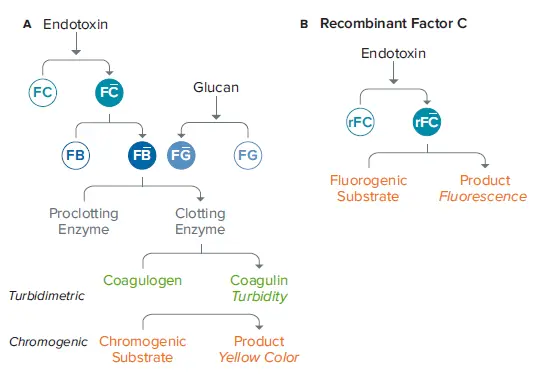
***図 1. LAL 法(A)と PyroGene rFC 法(B)の酵素カスケード。
*rFC アッセイでは酵素的工程が 1 回で済むため、カブトガニから LAL を採取する必要がありません。
材料
- PyroGene Recombinant Factor C Endpoint Fluorescent Assay (Lonza cat. #50-658U)
- LAL 試薬グレード ™ マルチウェルプレート (Lonza cat. #25-340)
- パイロジェンフリー希釈チューブ(Lonza cat.)
- LAL試薬水(Lonza cat.)
- SpectraMax i3またはi3xマルチモードマイクロプレートリーダー(Molecular Devices社製:蛍光検出機能を備えた他のSpectraMaxマイクロプレートリーダーも適しています。)
- SoftMax Proソフトウェア(Molecular Devices社製)
方法
キットに添付されている凍結乾燥大腸菌 O55:B5 エンドトキシンを、バイアルに記載されている容量の LAL 試薬水で再構成し、20 EU/mL のストック溶液を作りました。ボルテックスミキサーを使用してバイアルを高速で15分間振とうし、完全に再構成しました。LAL試薬水で原液を希釈し、希釈ごとに激しく振とうすることにより、以下の濃度の標準液を調製しました: 5 EU/mL、0.5 EU/mL、0.05 EU/mL、0.005 EU/mL、0.001 EU/mL。PyroGene アッセイは 0.005 EU/mL から 5.0 EU/mL まで直線的になるように最適化されていますが、SpectraMax i3 リーダーの感度をテストするために標準濃度(0.001 EU/mL)を追加しました。
プレートリーダーの温度を37℃に設定し、37℃に達してからプレーティングを開始。100μLのブランクまたはエンドトキシン標準物質(トリプリケート)をマイクロプレートのウェルに添加。プレートを37℃で最低10分間プレインキュベート。
プレインキュベーション中に、発蛍光基質、アッセイバッファー、rFC 酵素液をそれぞれ 5:4:1 の割合で混合し、作業試薬を調製しました。10分間のプレインキュベーションの後、各ウェルに100μLの作業試薬を添加しました。
SpectraMax i3 リーダーの温度は、アッセイ中37℃に保たれました。プレートは、表 1 に示す設定を用いて、時間ゼロ(作業試薬添加後)で読み取 りました。SoftMax ProソフトウェアでPMTゲインをAutomaticに設定すると、感度設定を決定する必要なく、全サンプル範囲にわたって正確な結果が得られました。最初にプレートの高さの最適化を行い、最適化された2 mmの読み取り高さをその後の測定に使用しました。
| パラメータ | セッティング |
|---|---|
| 光学構成 | モノクロメーター |
| 読み取りモード | FI (蛍光) |
| 読み取りタイプ | エンドポイント測定 |
| 波長 |
Ex: 380 nm、バンド幅15 nm Em: 440 nm, バンド幅 25 nm |
| プレーティングタイプ |
96ウェルCostar clear |
| 読み取り領域 |
(ユーザー選択) |
| PMTと光学系 |
PMTゲイン: 自動 読み取りごとのフラッシュ数:6 上部からの読み取り(デフォルト) 読み取り高さ: 2 mm |
***表1. SoftMax ProソフトウェアでのSpectraMax i3リーダーのインストゥルメンテーション設定 **表1。
PMTゲインをAutomaticに設定すると、リーダーの感度設定を決定する必要がなくなります。
1回目(T0)の読み取り後、プレートを37℃で1時間リーダー内でインキュベートし、同じ設定で2回目の読み取りを行いました。読み取り-インキュベート-読み取りシーケンスは、SoftMax Proソフトウェアのワークフロー機能を使用して自動化できます(図2)。
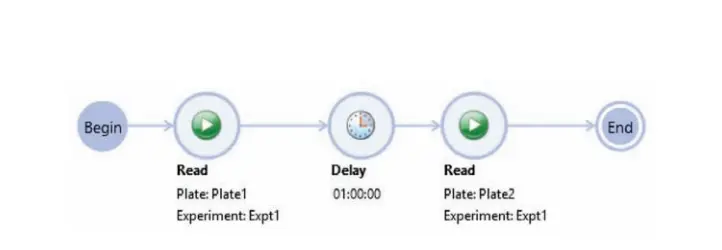
***図 2. SoftMax® Proソフトウェアでのワークフローのセットアップ。
時間ゼロで最初の読み取りを行い、その後1時間の遅延(インキュベーション)を経て、プレートを再度読み取ります。ワークフロー開始前に、インストゥルメンテーションは37℃に設定されています。
2回目(T60)のプレート読み取り後、以下の式を用いて各標準について正味ΔRFUを算出しました: (STDT60-STDT0)-(BLT60-BLT0)、ここで...
- STD T60は、1時間の時点での標準RFU
- STD T0は、ゼロ時点の標準RFU
- BL T60は1時間後のブランクRFU
- BL T0は、ゼロ時点のブランクRFU
結果
SpectraMax i3リーダーがPyroGeneアッセイに適していることを示すために、SoftMax ProソフトウェアでΔRFUの対数対濃度の対数をプロットして標準曲線を作成しました(図3)。
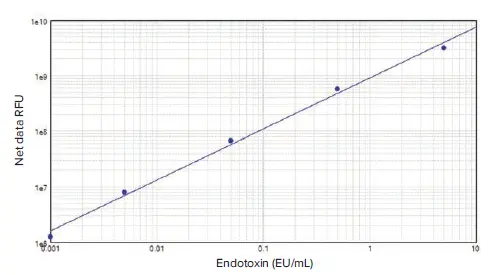
***図3. PyroGene rFC アッセイ標準曲線。
標準曲線はSoftMax® Proソフトウェアでlog-logカーブフィット処理を用いて作成され、0.001 EU/mL から 5 EU/mL までのコントロール標準エンドトキシンの5倍希釈液で構成されています(R2=0.996)。
0.001EU/mLから5EU/mLまでの5種類のエンドトキシン希釈液を使用してアッセイを実施しました。二重標準物質のCVは5%未満でした。R2値は0.996であり、標準曲線はこの広い濃度範囲を通して優れた直線性を示しています。SpectraMax i3 リーダーは、製品添付文書に記載された範囲(0.005 EU/mL~5.0 EU/mL)よりも低濃度のエンドトキシンを検出でき、蛍光アッセイにおけるエンドトキシンの検出感度が向上していることを示しました。
結論
SpectraMax i3 マルチモードマイクロプレートリーダーとPyroGene Recombinant Factor C アッセイとの組み合わせにより、再現性間のばらつきが少なく、検出下限を下回る感度の直線標準曲線が得られることから、SpectraMax i3 マルチモードマイクロプレートリーダーの優れた性能が実証されました。SpectraMax i3x リーダーや他の蛍光検出機能付き SpectraMax リーダーでも同様の結果が得られます。
データ解析には SoftMax® Pro ソフトウェアを使用し、算出された正味ΔRFU 値を用いて標準曲線をプロットし、R2 値を算出し、非常に低いエンドトキシンレベルの検出における本リーダーの感度を示しました。
PDF版(英語)