Application Note Sword ELISAブースターで炎症性サイトカインを
ピコグラムレベルで検出
- 低濃度分析物の高感度測定
- 特許取得済みSword分子による従来のELISAケミストリーの強化
- 低いバックグラウンドノイズとCVs
PDF版(英語)
はじめに
キャシー・オルセン(PhD)、鄒北燕(PhD)、尹永美(PhD)
アプリケーションサイエンティスト|モレキュラーデバイス
ホースラディッシュ・ペルオキシダーゼ(HRP)基質3,3',5,5'-テトラメチルベンジジン(TMB)を用いる従来のELISA(酵素結合免疫吸着測定法)では、炎症性サイトカインのような低存在量の分析物は検出できないことが多い。Sword Diagnostics社は、Sword ELISA Boosterを開発した。Sword ELISA Boosterは、次世代のELISA検出技術であり、従来のゴールドスタンダードELISAの検出試薬を直接置き換えることで、感度を最大30倍まで向上させることができる。
Sword ELISA Boosterは、特許取得済みの検出試薬を加えたイムノアッセイ化学を使用している。Sword分子はホースラディッシュ・ペルオキシダーゼ(HRP)の存在下で共鳴ラマン活性基質に変換され、共鳴ラマンシグナルが蛍光マイクロプレートリーダーで検出される。低濃度での優れた酵素/基質相互作用により、より多くの共鳴ラマン活性分子が生成されるため、アッセイの性能が向上する。このアッセイは、従来のELISA検出ケミストリーと比較して、高感度、一貫した低CV、低ノイズを可能にする。
ここでは、炎症性サイトカインTNF-αとIL-1ßのELISAをSword ELISA Boostersを使用して実施し、Molecular Devices SpectraMax® iD3、i3x、M5マルチモードマイクロプレートリーダーの蛍光読み取りモードを使用して検出しました。いずれの分析物も、3 種類のリーダ ーとも低 pg/mL レベルで測定された。
材料
- Sword ELISA Booster for Human IL-1ß (Sword Diagnostics社カタログ番号:SB-HIL1B02-05)
- ヒト IL-1ß/IL-1F2 デュオセット ELISA (R&D Systems 社) (カタログ番号: DY201)
- ヒトTNF-α用Sword ELISAブースター (Sword Diagnostics cat. #SB-HTNFA02-05)
- ヒトTNF-αデュオセットELISA(R&D Systems社、カタログ番号DY210)
- Immuno Clearスタンダードモジュール(ストリップウェルプレート)、Nunc MaxiSorpプレーティング(Thermo Scientific社、カタログ番号#445101)
- SpectraMax iD3マルチモードマイクロプレートリーダー
- SpectraMax i3x® マルチモードマイクロプレートリーダー
- SpectraMax M5マルチモードマイクロプレートリーダー
- MultiWash+ マイクロプレートウォッシャー
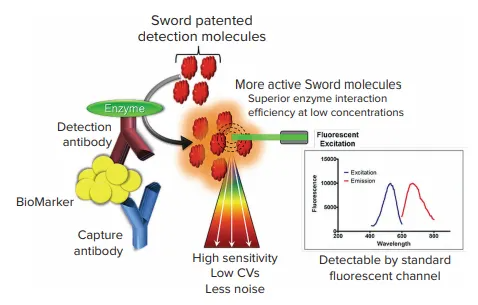
図1. Sword ELISA Booster技術。特許取得済みのSword分子は蛍光リーダーを用いて検出される。
方法
両キットの作業溶液の調製、プレートの調製、アッセイ手順は以下に記載されています。試薬の取り扱いや測定法に関する詳細は、各キットの添付文書をご参照ください。
ソードELISAブースター基質溶液
96 ウェルプレート 1 枚分の 16 mL Sword ELISA Booster 基質溶液を調製するため、11.2 mL の脱イオン水に以下を加えた:
- 1.6 mL ソードブースター コンポーネントA (10X)
- 1.6 mL ソードブースター コンポーネントB (10X)
- 1.6 mL ソードブースター成分C (10X)
1Xソード開発ソリューション
96ウェルプレート1枚分の16 mL Sword Development溶液を調製するため、3.2 mLの5X Sword Development溶液(Component D)を12.8 mLの脱イオン水に加えた。
プレーティングの準備
IL-1ß と TNF-α の捕捉抗体はそれぞれ 0.5 mL の PBS で再構成し、濃縮抗体を調製した。濃縮したヒト TNF-α 捕捉抗体は PBS で 12 µg/mL に希釈し、ヒト IL-1ß 捕捉抗体は PBS で 4 µg/mL に希釈し、実用濃度の抗体を作製した。各アッセイプレートのウェルに希釈した抗体を 100 µL/ウェルずつプレーティングした。プレートを密封し、4℃で一晩インキュベートした。
MultiWash+ マイクロプレートウォッシャーを用い、ウェルを吸引し、400 µL/ウェルの洗浄バッファー(PBS + 0.5% Tween 20)で 3 回洗浄した。その後、プレートを 200 µL/ウェルの Sword ELISA Blocker for IL-1ß または TNF-α でブロッキングし、密封して室温で少なくとも 1 時間インキュベートした。吸引と洗浄を上記と同様に繰り返した。
アッセイ手順
ヒト IL-ß 標準液およびヒト TNF-α 標準液をそれぞれ 0.5 mL の脱イオン水で希釈し、標準濃縮液を調製した。標準品を試薬希釈液(PBS+1%BSA)で 3 倍(IL-1ß)または 4 倍(TNF-α)に連続希釈し、それぞれの標準曲線を作りました。IL-1βの標準濃度は2500 pg/mLから0.046 pg/mLまで、TNF-αの標準濃度は1000 pg/mLから0.244 pg/mLまででした。
IL-1ß 測定では、各ウェルに IL-1ß 用 Sword Diluent を 50μL ずつ添加し、その後各ウェルに 50μL ずつ標準品を添加しました。TNF-α測定では、各ウェルにTNF-α用Sword Diluentを100μL添加し、標準液を100μL添加した。プレーティングは密封し、室温で2時間振とう器でインキュベートした。その後、プレートを吸引し、上記のプレート調製の項と同様に洗浄した。
ヒト IL-1ß および TNF-α 検出抗体は、それぞれ 1 mL のキャリブレーター希釈液(PBS 中 10% BSA)または 1 mL の試薬希釈液(PBS + 1% BSA)で再構成した。各検出抗体は、R&D Systems のロット特異性分析証明書に記載されている使用濃度に希釈した。希釈した検出抗体100 µLをウェルに添加し、プレートを密封して直射日光を避け、シェーカー上で室温で2時間インキュベートした。吸引と洗浄のステップは前述のように繰り返した。
Sword ELISA HRP Conjugateを試薬希釈液で1:10,000に希釈し、各ウェルに100μLずつ添加した。プレーティングを密封し、直射日光を避け、シェーカー上で室温で20分間インキュベートした。吸引と洗浄のステップを前述のように繰り返した。
Sword Booster溶液150μLを各ウェルに添加し、プレートを振盪せずに暗所、室温で15分間インキュベートした。その後、150μLのSword Development溶液を各ウェルに添加し、プレートを暗所、室温で30分間インキュベートした。
プレートはSpectraMaxリーダーで表1に示す設定で読み取った。
|
パラメータ |
SpectraMax iD3 |
SpectraMax i3x | SpectraMax M5 |
|---|---|---|---|
| 光学構成 | 該当なし | モノクロメーター | 該当なし |
| Read mode | FL(蛍光) | ||
| タイプを読む | エンドポイント | ||
| 波長 |
530 nm Ex 710 nm Em |
530 nm Ex 710 nm Em |
530 nm Ex 710 nm Em (630 nm カットオフ) |
| プレーティングタイプ |
96ウェルスタンダード(最適化済み) |
||
| PMT and optics |
PMTゲイン: 自動 積分時間 500ミリ秒 上面からの読み取り 読み取り高さ:1 mm |
PMTゲイン: 高い 読み取りごとのフラッシュ数 6または100 上からの読み取り 読み取り高さ:5.34 mm |
PMTゲイン: 自動 読み取りごとのフラッシュ数: 100 上から読む |
表1. Swordアッセイ検出のためのSpectraMaxリーダー設定。SpectraMax iD3 および SpectraMax M5 リーダーはいずれもモノクロメーター ベースの光学系を使用しているため、設定で光学構成を選択する必要はありません。
結果
標準曲線は、標準物質の RFU 値の平均値と標準物質の濃度をプロットして作成した。SoftMax® Proソフトウェアで、Sword Diagnostics社が推奨する4パラメータのロジスティック曲線にデータをフィット処理した。
アッセイ性能は、検出限界(LOD)と定量下限(LLOQ)の推奨パラメータを用いて評価した。Sword Diagnostics社によって定義されたLODは、ゼロ標準の平均値とゼロ標準値の標準偏差の2倍の合計よりも大きなシグナルを持つ標準物質の最低濃度である。LLOQは、LOD以上の標準物質の最低濃度と定義され、逆算された精度は80%~120%、CVは25%以下である。
テストした3台のSpectraMaxリーダーはすべて、LLOQについて各製品の添付文書に示された基準を満たしていました。IL-1βキットのLLOQは0.42 pg/mL、TNF-αキットのLLOQは0.98 pg/mLです。SpectraMaxリーダーのLLOQはIL-1ßで0.41 pg/mL、TNF-αで0.98 pg/mLでした(表2)。
IL-1ß および TNF-α の標準曲線を SoftMax Pro ソフトウェアにプロットした(図 2 および 3)。EC50値は、各アッセイにおいて3人のリーダー間で同程度であった(表2)。
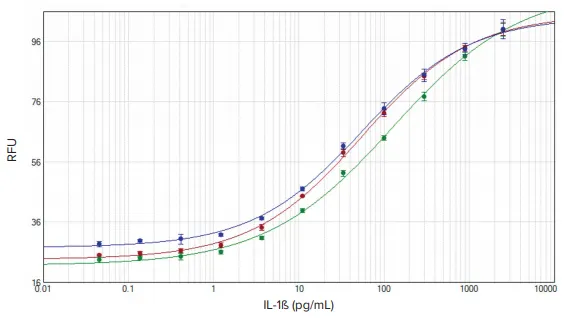
図2. IL-1ß 標準曲線。SoftMax Proソフトウェアの4パラメータカーブフィットを使用して、SpectraMax iD3(赤)、SpectraMax i3x(緑)、SpectraMax M5(青)リーダーで作成したデータをプロットした。
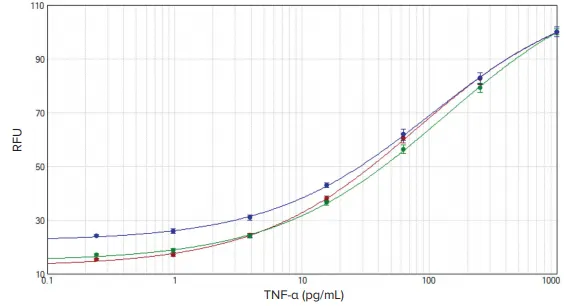
図3. TNF-α標準曲線。SoftMax Proソフトウェアの4パラメータカーブフィットを使用して、SpectraMax iD3(赤)、SpectraMax i3x(緑)、SpectraMax M5(青)リーダーで作成したデータをプロットした。
| プレートリーダー |
IL-1ß LLOQ (pg/mL) |
TNF-α LLOQ (pg/mL) |
IL-1ß EC 50 |
TNF-α EC 50 |
|---|---|---|---|---|
| SpectraMax iD3 | 0.41 | 0.98 | 54.6 | 78.9 |
| SpectraMax i3x | 0.41 | 0.98 | 127.0 | 131.7 |
| SpectraMax M5 | 0.41 |
0.98 |
54.3 | 101.5 |
表2. SpectraMaxリーダーで得られた定量下限値と標準曲線EC50値。
結論
テストした SpectraMax リーダー 3 台はすべて、Sword ELISA Boosters の感度基準を満たしました。この強化されたアッセイでは、R&D Systems社のDuoSet for Human IL-1ß with TMB substrateの感度が3.9 pg/mLであるのに対し、IL-1βは0.41 pg/mLの定量が可能です。TNF-αは、R&D Systems DuoSet for Human TNF-αが15.6 pg/mLであるのに対し、0.91 pg/mLまで定量できます。この9~17倍の感度向上により、より低濃度のサイトカインを検出し、これらの炎症メディエーターに関連する疾患の理解を深めることができます。
Sword ELISA Booster検出用に検証されたMolecular Devices社製リーダーには、以下のものが含まれる:
- SpectraMax® Paradigm® Multi-Mode Microplate Reader
- SpectraMax® i3x Multi-Mode Microplate Reader
- SpectraMax® iD3/iD5 Multi-Mode Microplate Readers
- SpectraMax® M3/M4/M5/M5e Multi-Mode Microplate Readers
- FilterMax™ F5 Multi-Mode Microplate Reader
謝辞
プレートリーダーのバリデーションを完了し、アッセイのセットアップと解析を支援してくれたSword Diagnostics社のMegan Dobbs氏に感謝する。
PDF版(英語)