Application Note ScanLater™ウェスタンブロット検出システムによる
タンパク質の検出と定量
- ウェスタンブロットのプロトコールは二次抗体とのインキュベーション以外は変更なし
- 基質不要
- ユーロピウム標識二次抗体を使用したTRF検出により、ダイナミックレンジを広げながらバックグラウンドを低減
- デジタルフォトンカウンティングにより、変化しないTRFカウントを提供
- ユーロピウムは光による白化に強く、数週間安定であるため、ブロットの再利用が可能
PDF版(英語)
はじめに
タンパク質の検出は今日の製薬および臨床研究にとって重要であり、ウェスタンブロットはこの目的のために採用される最も一般的な方法の一つである。ウェスタンブロットメンブレン上のタンパク質の検出には、蛍光や化学発光など様々な技術が用いられている。しかし、それぞれの技術には限界があり、定量性、精度、ダイナミックレンジの向上が常に求められている。ここでは、SpectraMax® i3およびSpectraMax® Paradigm®マルチモードマイクロプレートリーダーに組み込まれた、ウエスタンブロットメンブレンタンパク質分析のための新しいシステムについて報告します。バックグラウンドの減少によるダイナミックレンジの拡大、時間やリード数に対する検出の安定性を実証しています。さらに、ScanLaterウエスタンブロットシステムと化学発光法の比較では、感度の向上が実証されています。
測定原理
ScanLater®ウェスタンブロットシステムのワークフローは、二次抗体インキュベーションステップまでの標準的なゲルローディングおよびウェスタンブロッティングメソッドに従います。膜は、目的のタンパク質に結合した一次抗体に特異的に結合するユーロピウムキレート標識二次抗体またはストレプトアビジンとインキュベートされる(図1)。
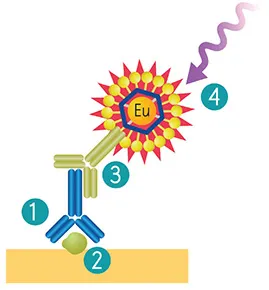
図1. ScanLaterウェスタンブロットシステムのワークフロー。目的のタンパク質(2)に結合させるために、既存の一次抗体(1)を使用します。Eu標識ScanLater二次抗体(3)を一次抗体に結合させる。ScanLater TRFウェスタンブロット検出カートリッジ(4)で検出。
画像は、蛍光寿命が1msのユーロピウム(Eu)の時間分解蛍光(TRF)モード検出を利用して生成される。これにより、自家蛍光や他の短寿命発光源からのバックグラウンドが大幅に低減されます。化学発光や標準的な蛍光イメージャー検出でよく見られるカメラのブルーミングがないため、シャープなバンドと優れた画質が得られます。
この方法は酵素検出を伴わず、Euキレートは光漂白に耐性がある。そのため、シグナルは数週間から数ヶ月間安定したままである。この安定性により、膜の繰り返し読み取りが可能となり、より正確な定量が可能となります。新しいScanLater™ ウェスタンブロット検出システムは、マルチモードプレートリーダーで優れたタンパク質分析能力を提供する、シンプルで高感度、安定したプラットフォームです。
SoftMax Proソフトウェアによるウエスタンブロットデータの解析
すべての実験は、SpectraMax i3またはSpectraMax Paradigmマルチモードマイクロプレートリーダー用のScanLater™ウェスタンブロット検出システムを使用して実施しました。マイクロプレート検出システムを使用することにより、明確な利点がある。第一に、デジタルフォトンカウンティングは、TRFカウントをローデータとして提供する。画像は最適化され、SoftMax® Proソフトウェアに保存することができます。生のカウントは、ソフトウェアによって、タンパク質の分析および定量化のために統合されたExcelマクロスプレッドシートに直接エクスポートすることもできます。また、データを直接ImageJにエクスポートして解析することもできます。
感度とダイナミックレンジ
グルタチオンS-トランスフェラーゼ(GST)を用いて、システムの感度とダイナミックレンジをテストした。GSTを1xランニングバッファーで3倍に連続希釈したものを4-20%グラジエントゲルにロードし、30分間反応させた。タンパク質をImmobilon FLメンブレンに移し、ビオチン標識ウサギ抗GSTで2時間プローブした後、ScanLater Eu標識ストレプトアビジンで1時間インキュベートした。ブロットを洗浄、乾燥し、SpectraMax Paradigmリーダーでスキャンした(図2)。本システムは、GSTの検出限界として4ピコグラム以下を示し、GST量に対するシグナルの陽性反応は4対数以上であった(図3)。
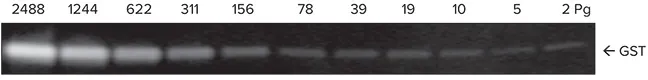
図2. SpectraMax ParadigmリーダーでスキャンしたGST希釈系列の画像。
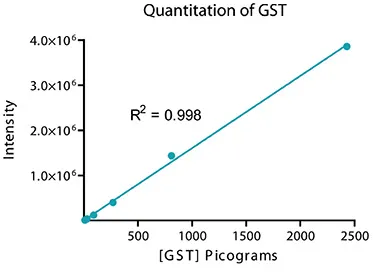
図3. SoftMax Pro統合Excelマクロで解析した図2の各バンドからの積分強度では、総ダイナミックレンジは4ログ、線形ダイナミックレンジは3ログであった。
信号の安定性
Euラベルの卓越した特徴は、シグナルの安定性と光漂白に対する耐性です。シグナルは数ヶ月間安定しているため、ブロットを後でスキャンすることができる。(図4と5)。

図4. Euラベルシグナルの安定性と光漂白に対する耐性。
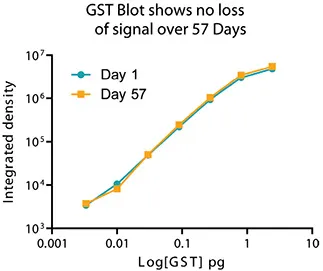
図5. 平均強度対GSTピコグラムのプロットは、57日後のシグナルの安定性を示している。
シグナルを失うことなくブロットを複数回スキャンすることができる
トランスフェリンを1 x サンプル緩衝液で2倍に連続希釈したものを4-20%グラジエントゲルにローディングし、30分間反応させた。タンパク質をImmobilon FLに移し、ウサギ抗トランスフェリンで2時間プローブした後、Eu標識抗ウサギIgGで1時間プローブした。ブロットを洗浄、乾燥し、SpectraMaxリーダーを用いて7回連続でスキャンした(図6)。
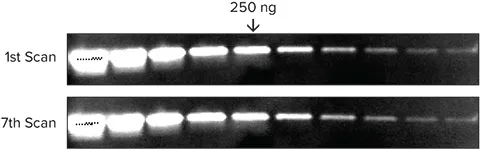
| 250ng | Area | Mean | Integrated Density |
|---|---|---|---|
| Scan 1 | 261 | 8678 | 2264874 |
| Scan 7 | 261 | 8609 | 2247047 |
図6. 信号は非常に安定しており、何度スキャンしても再現性がある。
化学発光ウエスタンブロットとの比較
HEK293T細胞を、DNA損傷を引き起こす発がん性物質であるメタンスルホン酸メチル(MMS)0、50、100ppmで処理した。抽出液(80 μg)をゲル上で分析し、ブロットをマウス抗Rad18でプローブした後、ScanLater Eu標識抗マウス抗体または化学発光アッセイ用のHRP標識抗マウス抗体(Immobilon Western Chemiluminescent HRP Substrate、Millipore cat. WBKLS 0500)。
Rad18はDNA損傷修復に必須の役割を果たすタンパク質である。ユビキチン化と非ユビキチン化の2つの形態で存在する。図7に示すように、MMSに暴露すると、ユビキチン化Rad18の量が減少し、非ユビキチン化Rad18の量が増加する。ScanLaterブロットの定量は、SoftMax Proソフトウェアを用いてシグナルをキャプチャーし、Excelマクロに直接エクスポートして解析しました。Alphainnotech化学発光イメージャーを使用して、化学発光ブロットのシグナルを捕捉しました。図8に示すScanLaterブロットの定量的解析から、MMSレベルの増加に対応してRad18タンパク質が増加し、ユビキチン化Rad18が減少していることが示された。この相関は化学発光法ではあまり明確ではなかった。
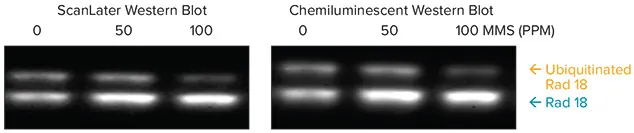
図7. ScanLaterウェスタンブロット検出システムと化学発光検出システムを用いたRad18の内因性型とユビキチン化型の検出の比較。
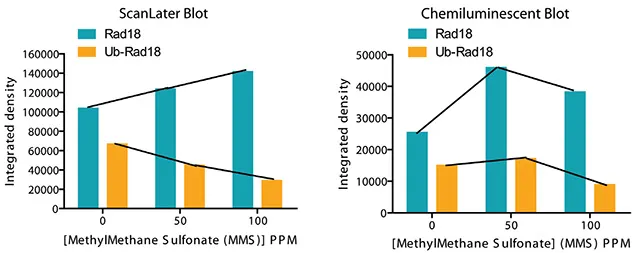
図8. スキャンレイターは、MMSレベルの上昇に伴う非修飾Rad18の量的増加とユビキチン化Rad18の量的減少を明確に検出した。このデータは、ScanLater TRFウエスタンブロットが化学発光ブロットと同様に高感度で、より正確であることを示しています。
結論
ScanLaterウェスタンブロットテクノロジーを使用することで、ユーザーはアプリケーションに最適化されたワークフローに従うことができます。Euで標識された二次抗体は、SpectraMax i3またはSpectraMax ParadigmマルチモードマイクロプレートリーダーのTRFモードで低バックグラウンド検出が可能です。画像はSoftMax Proソフトウェアに保存され、解析用にカスタムExcelマクロまたはImageJへの統合エクスポートが可能です。
ScanLater™ウェスタンブロット検出システムは、4 logsのダイナミックレンジと3 logsのリニアレンジでタンパク質を定量します。また、シグナルは時間や複数回のスキャンに渡って安定しています。ScanLater™ウェスタンブロット検出システムは、マルチモードマイクロプレートリーダーで優れたタンパク質分析能力を提供するシンプルで高感度、安定したプラットフォームです。
PDF版(英語)