Application Note FLIPRカリウムアッセイキットを用いた
細胞ベース塩化カリウムトランスポーターアッセイの開発
- 細胞ベースのアッセイでK + /Cl - 共トランスポーター活性をカイネティックに測定し、豊富なデータを提供
- ホモジニアスな無洗浄プロトコールによりウェル間のばらつきを低減し、アッセイのロバスト性を向上。
- 非放射性試薬(従来のRb+排出アッセイとは異なる)
- ハイスループットスクリーニングに適している。
PDF版(英語)
はじめに
カリウム-塩化物トランスポーター・メンバー5(SLC12A5、またはKCC2)は、SLC12ファミリーの遺伝子によってコードされる9つの陽イオン-塩化物共輸送体(CCC)の一つであり、神経細胞で優先的に発現する唯一のCCCトランスポーターである。KCC2は中枢神経系の正しい機能において重要な役割を果たしており、神経細胞の細胞内Cl濃度([Cl-]i)の維持に極めて重要である。KCC2は多くの神経細胞プロセスの制御に関与しており、その活性低下はてんかん、神経因性疼痛、脊髄損傷後の痙縮で確認されている1。このことから、KCC2の活性や発現を陽性に調節する薬剤が、KCC2の機能障害に起因する神経疾患に対して有効な治療法となる可能性が示唆される。
FLIPR®Potassium AssayKitには、新規の高感度タリウム(Tl+)インジケーター色素が封入されており、カリウムチャネルを通して導入されたTl+と結合すると明るい蛍光を発します。シグナルの強度は細胞上のカリウムチャネルの開口数に比例するため、カリウムイオンチャネル活性の代用指標として機能します。このキットはまた、Molecular Devices社特許取得済みのマスキング色素を使用してバックグラウンド蛍光を低減し、SB比を向上させています。Tl+は陽イオン-塩化物共輸送体によっても輸送されるため、FLIPR PotassiumAssay Kitは、KCC2を介したTl+輸送/流入の初期速度を測定することで、KCC2活性に対する化合物の影響を簡単に評価することができます。
測定原理
このアッセイキットのTl+指標色素は、非ホモジニアスアッセイに比べてシグナルウィンドウが拡大されている。BTC-AMはCa2+指標であり、Tl+イオンがBTCの蛍光を増強することから、カリウムチャネルのモニタリングにも使用されている。色素負荷の段階で、Tl+指標色素は細胞膜を通過する受動的拡散によってアセトキシメチル(AM)エステルとしてセル内に入る。細胞質エステラーゼがAMエステルを切断し、活性のある発蛍光体を放出する。アッセイキットには、バックグラウンド蛍光を低減するため、特許取得済みの細胞外マスキング色素が含まれている(図1)。カリウム-塩化物トランスポーターを活性化するために、セルは試験化合物(KCC2阻害剤など)の存在下または非存在下で、K+とTl+の混合物で刺激される。使用したアッセイ条件下では、蛍光シグナルの増加は共トランスポーターを介したTl+の特異的な細胞内流入を表し、したがって共トランスポーター活性の機能的測定を意味する。共トランスポーター活性の調節は、KCC2阻害剤の添加によって達成される。
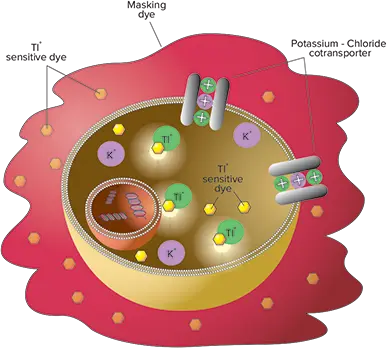
***図1. FLIPR Potassium Assay Kitの原理。
細胞質TI+の増加は、タリウム感受性色素インジケーターを用いたFLIPRまたはFLEXstationシステムで検出される。
FLIPR Potassium AssayExplorer Kit(Molecular Devices、カタログ番号 R8222)には、Tl+感受性色素、ホモジニアス操作用マスキング色素、200 mM K2SO4、50 mM Tl2SO4、5X 塩化物フリー緩衝液、20 mM HEPES緩衝液入りHBSSが封入されています。キットは96、384、または1536ウェルプレート10枚分です。アッセイのワークフローを図2に示す。

図2. FLIPR TetraハイスループットセルラースクリーニングシステムにおけるFLIPRカリウムアッセイキットのワークフロー。
実験手順
細胞培養とトランスフェクション
HEK293T(ECACC Cat.#12022001)細胞を、増殖培地(10% FBSおよび2mM L-グルタミン添加DMEM)を封入したT75フラスコで80-90%コンフルエンスまで増殖させた。培養は5% CO2存在下、37℃で維持した。セルは1:6の割合で3-4日ごとに継代した。アッセイの2日前に、Lipofectamine 2000 (Thermo Fisher Cat. # 11668027)を用いて、細胞をヒトKCC2 (hKCC2)で一過性にトランスフェクトした。トランスフェクション混合物を増殖培地と混合し、黒壁透明底96ウェルプレートに10,000細胞/ウェルで直接プレーティングし、37℃、5%CO2で48時間インキュベートした。
KCC2阻害アッセイ
成長培地をプレーティングプレートから除去し、FLIPR PotassiumAssay KitまたはBTCAM(2 µM)と37℃、暗所で1時間インキュベートした。ローディングバッファーには、内因性のNKCC Tl+流入/輸送シグナルを減少させるために10μMのブメタニド、細胞膜を介したATP依存性のナトリウム-カリウム交換を阻害するためにNa+/K+-ATPaseブロッカーである0.1mMのウアバインを封じ込めた。色素負荷ステップの後、BTC-AMとインキュベートしたセルを洗浄して余分な色素を除去した。KCC2阻害剤を添加し、色素負荷時間の最後の45分間インキュベートした(FLIPR Potassium Assay Kitonly)。470-495nmの励起LEDと515-575nmのエミッションフィルターを用いてFLIPR®Tetraシステムで検出する間、最適化した刺激バッファー(9 mM K+/ 0.9 mM Tl+)をウェルに添加した。データファイルは、SoftMax® Pro 6.4.1以降で利用可能なインポート機能(図3)を使用して、その後の解析のためにSoftMax® Proデータ収集・解析ソフトウェアにインポートされました。初期速度(Vmax、単位は秒)は、刺激添加後の最初の10秒間のデータから計算した。

図3. SoftMax Pro 6.4.2のインポート・ワークフロー。
結果
hKCC2をトランスフェクトしたHEK293細胞またはモックトランスフェクトしたHEK293細胞に、新規のFLIPRカリウムアッセイキットまたはBTC-AMを負荷した後、FLIPR TetraSystemで検出中に外部からのTl+添加によって引き起こされる蛍光の増加を測定した。FLIPR Potassium AssayKitを負荷した細胞では、Tl+添加後最初の10秒間にhKCC2駆動FLIPRシグナルが急激に増加し、その後ゆっくりと増加し、最終的にプラトー期に至った。図4に示すように、hKCC2-発現細胞では、モックトランスフェクション細胞と比較して有意に高い上昇を示した(P < 0.001;スチューデントのt検定)。平均Zファクターは0.60±0.05と計算され、ロバスト性アッセイであることが示された2。対照的に、BTC-AMを負荷した細胞では、シグナルの発現が非常に遅く、ばらつきが大きく、シグナルの大きさもはるかに小さかった。これらの理由から、アッセイキットとBTC-AMの比較はこれ以上行われなかった。
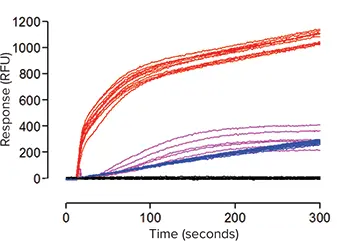
***図4. FLIPR Potassium Assay KitまたはBTC-AMを添加したHEK293細胞のFLIPR Tetraシステムで得られた代表的な蛍光シグナルのトレース(各処理につき6ウェル以上)。
データは、hKCC2トランスフェクト細胞ではバッファーのみの添加(-)またはTl+添加(-)、FLIPR Potassium Assay Kitを負荷したモックトランスフェクト細胞ではTl+添加(-)の効果を示す。比較のため、BTC-AMを負荷したトランスフェクト細胞におけるTl+添加(-)の効果も示す。
次に、Tl+流入アッセイを用いてhKCC2活性のモジュレーターを検出できるかどうかを評価するために、FLIPR PotassiumAssay Kitを負荷したhKCC2発現セルを用いて一連の実験を行った。各96ウェルプレートで、セルをビヒクルコントロールまたは30μM R-(+)-DIOA(K+/Cl-共輸送体の強力かつ選択的阻害剤であることが示されているアルカン酸)で処理した。図5に見られるように、K+/Tl+誘発による蛍光の増加から得られたシグナルは、ウェルごとに非常に一貫しており、コントロールとR-(+)-DIOAシグナルの間の分離は有意であった(P < 0.001;スチューデントのt検定)。
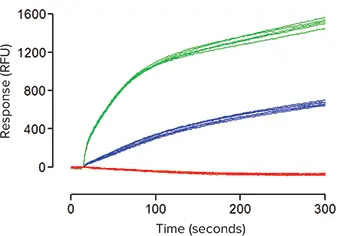
***図5. FLIPR Potassium Assay Kitを負荷したhKCC2-トランスフェクト細胞のFLIPR Tetraシステムで得られた代表的な蛍光トレース。
データは、30 µM R-(+)-DIOAの非存在下(-)または存在下(-)でのバッファーのみの添加(-)またはTl+添加の効果を示す。
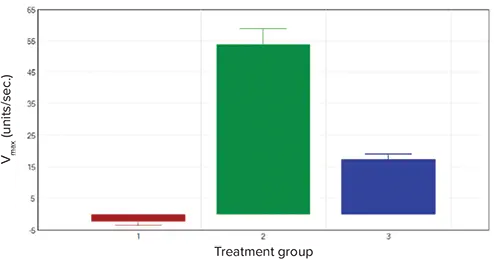
***図6. hKCC2トランスフェクト細胞に対する様々なチャレンジの効果。
データは3つの異なる処理グループの効果を示す:1.緩衝液のみの添加(■)、2. 30μMのR-(+)-DIOAの非存在下(■)または存在下(■)でのTl+/K+添加。バーは平均Vmax(units/sec.)±SEMを表す(n≥30)。
結論
我々は、FLIPR PotassiumAssay Kitを用いることで、ホモジニアスで洗浄不要なプロトコルを用いてhKCC2陽イオン-塩化物共輸送体の機能活性を測定できることを示した。このアッセイキットは大きなアッセイウィンドウと優れた再現性を示し、hKCC2活性の既知のモジュレーターを検出することに成功した。BTC-AMのような従来の色素と比較して、簡便なプロトコールとロバスト性の高いアッセイキットは、FLIPR TetraSystemのハイスループット機能と相まって、hKCC2コトランスポーターのモジュレーターをスクリーニングするための強力なソリューションとなる。
謝辞
アンドレア・タウンゼント・ニコルソン、ステファニー・ショージ(ユニバーシティ・カレッジ・ロンドン)、サイモン・リドフォード(モレキュラー・デバイセズ(UK)社
参考文献
- Kahle KT, Staley KJ, Nahed BV, Gamba G, Hebert SC, Lifton RP, et al. 神経疾患における陽イオン-塩化物共輸送体の役割。*2008;4:490-503。
- Zhang JH, Chung TD & Oldenburg KR. ハイスループットスクリーニングアッセイの評価とバリデーションに使用する簡単な統計パラメータ。*J Biomol Screen.*1999;4:67-73.
PDF版(英語)