Application Note Fura-2を用いた血小板カルシウム流動アッセイの開発
FlexStation 3リーダーを用いたAM
- 血小板の細胞内Ca2+変化をリアルタイムでカイネティック測定することで、情報量の多いデータが得られる。
- キュベットから½面積のウェルプレートにアッセイを小型化できるため、血小板および化合物の使用量が減少する
- オンボードピペッターにより、FLEXstation 3リーダーでのウェル間再現性とアッセイのロスト性が向上
PDF版(英語)
はじめに
血小板は小さな無核の血液細胞で、血管の損傷部位で凝集して血栓(または血の塊)を形成し、出血を抑えることによって止血を仲介する。血小板が血管の損傷に不適切に反応すると、心臓発作や虚血性脳卒中などの血栓性疾患につながる。第1段階は接着(血小板が損傷した血管内皮の露出したマトリックスタンパク質に接着する)、第2段階は活性化(形状の変化や化学伝達物質の分泌など、受容体を介したイベント)、第3段階は凝集(血小板同士の接着)である。血小板接着の際、血小板はまず糖タンパク質VIレセプター(GPVI)を介してコラーゲンによって活性化され、次にアデノシン二リン酸(ADP)やトロンボキサンA2(TxA2)のような様々な分泌型アゴニストによって活性化され、Gタンパク質共役型レセプター(GPCR)を活性化する。これらの受容体は、血小板に発現する2種類のホスホリパーゼC(PLC)アイソフォーム、PLCßまたはPLCγ2のいずれかと結合し、その後カルシウム(Ca2+)が濃細管系(DTS)から細胞質に放出される。DTSからのCa2+の枯渇は、貯蔵作動性Ca2+エントリーとして知られる機構を介して細胞外Ca2+の流入を引き起こす。これらのメカニズムによる細胞質Ca2+の上昇は、接着、形状変化、凝集を含む血小板機能のあらゆる側面を支えている。この血小板機能の重要な制御因子を、様々なアゴニストが健康状態や疾患においてどのように調節するかを理解することは、新規で安全な抗血栓薬の開発の指針となるであろう。
ここでは、高親和性蛍光カルシウム指示薬Fura-2, AMを用いて、ヒトの主要組織であるヒト血小板のCa2+フラックスをマイクロプレートフォーマットで容易に測定することが可能であることを示す。96ウェルハーフエリアマイクロプレートでアッセイを小型化し、FLEXStation® 3 マルチモードマイクロプレートリーダーのフレキシブルな液体移動機能を用いることで、アゴニストのEC50値とアンタゴニストのIC50値を迅速かつ確実に測定できることを示す。
方法
血小板調製
健常人ドナーから50mLの血液を採取し(地域の倫理に従って)、4%クエン酸ナトリウム(最終0.32%)を封じ込め、全血50mLあたり7.5mLの酸性クエン酸ブドウ糖(110mMグルコース、80mMクエン酸、120mMクエン酸ナトリウム)を加える。次にチューブを100 gで20分間遠心し、パスツールピペットで血小板豊富血漿(PRP)を除去する。血小板を数える。次にFura-2, AMを最終濃度2 µMになるように加え、チューブを反転させて穏やかに混合し、暗所30℃で60分間、15分ごとにチューブを反転させながらインキュベートする。最後に、PRPを350 gで20分間遠心し、血小板ペレットを4 x 108 platelets/mLのチロ-ド液に懸濁する。血小板を15分間静置する(図1)。

図1. FlexStation 3リーダーでFura-2、AMを用いた血小板Ca2+ アッセイのワークフロー
カルシウムフラックス測定
40μLの血小板懸濁液(最終濃度の阻害剤またはビヒク ルを含む)を、黒壁透明底96ウェルプレートの1カラム の各ウェルに添加する。データ取得前にFLEXstation 3リーダー(37℃に設定)で5分間インキュベートする。
励起波長340 nmおよび380 nm、発光波長510 nmで検出されたベースライン蛍光シグナルを測定する。オンボードピペッターを用い、15秒後に5Xアゴニストを10 μL加え、さらに285秒間シグナルをモニターする(図2)。
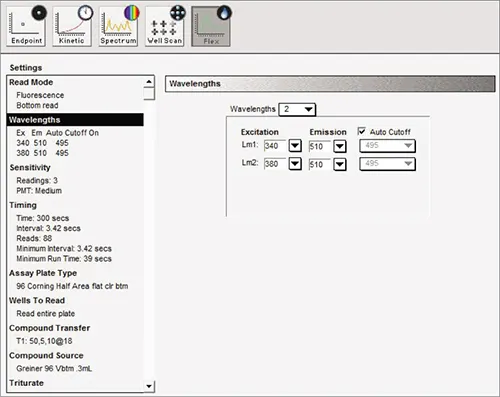
図2. SoftMax® Proデータ収集・解析ソフトウェアの推奨ソフトウェア設定。
測定結果
アゴニストEC50値の測定
血小板GPCRの3つの既知のアゴニストに対する濃度反応曲線を求め、その後のアンタゴニスト研究のためのEC80値を計算するために、最初の実験を行った。選ばれたリガンドはADP、U46619、架橋コラーゲン関連ペプチド(CRP-XL)で、それぞれプリン作動性P2Y1レセプター、プロスタノイドTPレセプター、GPVIレセプターに作用する。アゴニストの添加は、細胞質Ca2+の急激な上昇を引き起こし、その結果、510 nm Emissionで検出された340 nmと380 nmの両方のシグナルに変化が生じた(図3)。
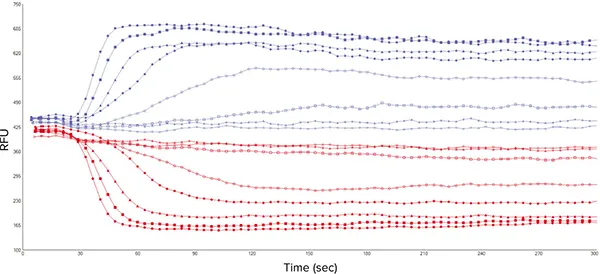
図3. 96ウェルマイクロプレートの8ウェルから得られた代表的な340 nmと380 nmの蛍光シグナルトレース。CRP-XL(7種の濃度とビヒクルコントロール)で刺激したFura-2、AMローディング血小板からFLEXstation 3で得られたシグナル。
図4は、SoftMax® Proソフトウェアで340/380比のデータを解析した結果であり、カラム-カラム間および日間値と同様に、これまでの社内値および文献値と一致するEC50値が得られた(表1)。
| 平均EC | N | アッセイZ' | |
|---|---|---|---|
| ADP | 0.71 µM | 10 | -0.4 |
| U46619 | 0.12 µM | 13 | 0.49 |
| CRP-XL | 0.36 µg/mL | 11 | 0.61 |
表1. 図4に示したE/[A]曲線解析の要約。アッセイZファクターはアッセイのロバスト性を定量化する統計的試みである。Zファクターが0.5から1.0の間は優れたアッセイであり、0から0.5の間は限界のアッセイとみなされる。
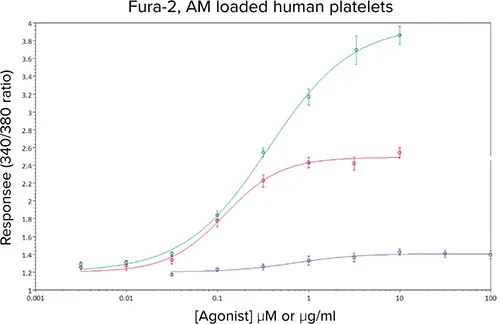
図4. Fura-2、AM負荷ヒト血小板におけるADP(-)、U46619(-)およびCRP-XL(-)に対する濃度反応曲線。データは平均値±sem、5つの独立した実験からn≧10。
反応の再現性と蛍光シグナルの大きさから、U46619とCRP-XLのアッセイZ'ファクターが得られ、このアッセイがその後のIC50値の決定に適していることが示された。
アンタゴニストIC50値の測定
アンタゴニストIC50試験のために、個々のアゴニストEC80濃度を毎日測定した。EC50/80値が許容範囲内であれば、FLEXstation 3リーダー内で5分間の平衡化ステップの間、阻害剤をFura-2、AM負荷血小板とインキュベートした。ADPではアッセイウインドウが小さかったため、阻害曲線はTPレセプター(U46619を使用)とGPVIレセプター(CRP-XLを使用)のみに作成することにした。TPレセプターに対しては、トロンボキサンA2レセプター拮抗薬GR32191Bを使用することにし、GPVIレセプターに対しては、GPVIレセプターの下流にある異なるキナーゼを標的とする、最近報告された2つの阻害剤を使用することにした。
プロスタノイドTP受容体拮抗薬GR32191Bの濃度を増加させると、U46619のEC80チャレンジに対するCa2+応答の濃度依存的な減少が観察された(図5)。算出されたIC50は5 nMであり、キュベットベースのCa2+アッセイで得られた以前の値とよく比較された(データは示さず)。
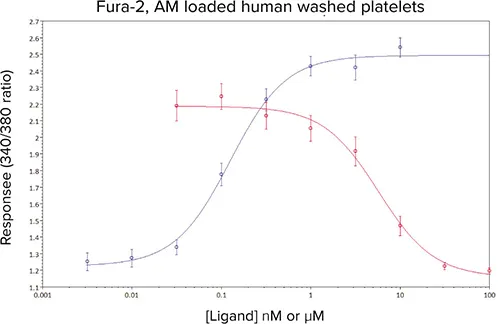
図5. U46619(-)、および8つの異なる濃度のGR32181B(-)存在下でのU46619(EC80濃度)の平均濃度効果曲線。データは平均値±sem、5回の独立した実験からn≧10。
図6では、最近報告された2つの新規チロシンキナーゼ阻害剤がCRP-XLに対する反応に及ぼす影響を見ることができる。CRPXLに対する濃度反応曲線は、わかりやすくするために記載した。これらのアッセイ条件下で、阻害剤#1(赤線)と阻害剤#2(緑線)のIC50推定値は、それぞれ0.15μMと0.16μMと計算された。
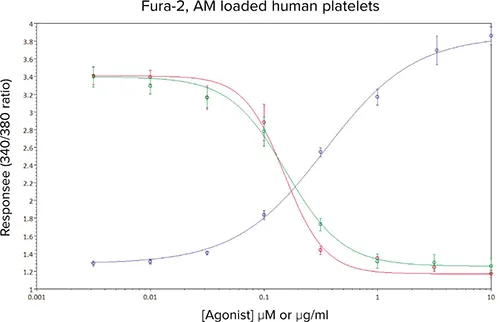
図6. キナーゼ阻害剤#1(-)およびキナーゼ阻害剤#2(-)存在下でのCRP-XL(-)およびCRP-XL(EC80濃度)の平均濃度-効果曲線。データは平均値±sem、5回の独立実験からn≧10。
このアッセイから計算されたIC50値は、より低スループットのマイクロプレートベースのCa2+アッセイで得られた以前のデータとよく比較された(データは示さず)。
結論
細胞内Ca2+は血小板機能のマスターレギュレーターであり、血栓性疾患において重要な役割を担っているが、脆弱なヒト血小板では測定が困難である。ここで述べたFLEXstation 3リーダーアッセイにより、アゴニストのEC50とアンタゴニストのIC50の正確かつ迅速な推定値の測定が可能となり、この一次ヒト組織を用いた新規薬剤のミディアムスループットスクリーニングをサポートすることができる。
謝辞
Alexander P. Bye & Jonathan M. Gibbins: レディング大学 Simon Lydford: モレキュラー・デバイス(UK)社
FlexStation 3 マルチモードマイクロプレートリーダーについて詳しく >>
PDF版(英語)