Application Note ヒト白血病U937細胞に対する
化合物の細胞毒性および抗増殖活性を
直接スクリーニング
- ラベルフリーで非侵襲的なイメージャーによる生細胞増殖の評価
- 検出試薬の削減によるコストの最小化
- データ収集に必要なサンプリングやピペッティングのステップを省くことでエラーを削減
- 検出試薬とインキュベーション時間を省くことで、アッセイ時間を90秒以下に短縮
PDF版(英語)
はじめに
Shan Liu, PhD | Product Specialist | Molecular Devices
Rebecca Kreipke, PhD | Field Applications Scientist | Molecular Devices
創薬の初期段階における抗増殖および毒性評価のための、迅速で信頼性が高く、費用対効果の高いハイスループットスクリーニング法は非常に魅力的である。細胞生存率と増殖を評価する従来の方法は、MTTアッセイ1 のような比色分析を利用している。MTS(5-(3-carboxymethoxyphenyl)-2-(4,5-dimenthylthiazoly)-3-(4-sulfophenyl)tetrazolium)は、細胞生存能の指標として紫色の水溶性ホルマザンを生成するMTTの類似物質である。いくつかの "ワンソリューション "アッセイ(細胞毒性アッセイ- ab112118 )は、より高い感度と安定性を達成するために、細胞の還元により吸収スペクトルが変化する特許取得済み水溶性色素を使用している。
広く使用されている吸光度ベースの比色細胞毒性分析法には、共通の限界がある。それらは、インキュベーション時間や温度などの環境条件に敏感であり、エンドポイントのみの読み出しを提供し、さらに重要なことに、細胞代謝検出試薬に依存する破壊的な方法である。大規模な細胞パネルで多数の潜在的化合物をスクリーニングするためには、高速でコスト効率が高く、信頼性の高いシステムが望まれ、薬理学研究を大幅に加速することができます。
CloneSelect® Imaager (CSI)は、このような課題に専門的に対応します。CSIは、さまざまなマイクロウェルプレートの全ウェルの画像を、非常に高速なデータ取得(96ウェルプレート全体で90秒)で取り込みます。取得したデータは、エクセル・スプレッドシートとしてエクスポートしてさらに分析することも、一連の円グラフとして視覚的に表示することもできる。自動細胞検出とウェルのコンフルエンス判定アルゴリズムにより、CSIは標識不要、非侵襲的、かつリアルタイムで各ウェルの細胞増殖を直接分析し、複数のタイムポイントで細胞増殖をモニターすることができる。
従来の比色分析による細胞毒性アッセイとCSI画像ベース、標識不要の細胞毒性アッセイとのワークフロー比較(図1)は、CSIアッセイがアッセイ検出試薬の使用とインキュベーション時間を省くことにより、総アッセイ時間を141分から2分未満に短縮することを示している。さらに、本研究は、抗がん剤の細胞毒性および抗増殖活性評価におけるCSIの利用を実証している。ハイスループット・スクリーニングのロバストな細胞モデル2であるヒト単球U937細胞株を、3種類の抗がん剤の細胞毒性評価に使用した: 5-フルオロウラシル(5-Fu)3、シスプラチン、オキサリプラチン4である。その結果、CloneSelect Imaferは、ヒト非接着性白血病細胞株U937に対するさまざまな抗がん剤の細胞毒性を測定する際に、迅速で信頼性が高く、低コストな代替手段を提供することがわかりました。

図 1. 従来の比色吸光度ベースの細胞毒性分析とClone Select Imager (CSI)画像ベースの標識不要細胞毒性分析のワークフロー比較。*サンプルあたりの試薬コストは、本試験で使用したAssay kit #1とAssay kit #2の価格から算出した。
材料と方法
材料と方法
- アッセイキット#2: 細胞毒性アッセイキット (Abcam cat. #ab112118)
- ヒト単球U937細胞株(ATCC cat.)
- 5-フルオロウラシル (Millipore Sigma cat. #F6627)
- シスプラチン(Millipore Sigma cat.)
- オキサリプラチン(Millipore Sigma cat.)
- コーニング96ウェルマイクロプレート(Corning cat.)
アッセイ前のセルプレーティング
各アッセイが広範囲の生細胞を正確に検出できることを検証するため、U937細胞をコーニング96ウェルマイクロプレートに1ウェル当たり312~10,000個プレーティングした。各プレートの最初のカラムには培地のみを封じ込め(セルなし)、データ解析用のブランクコントロールとした。未処理のセルは、アッセイに先立ち、37℃、5% CO2で24時間静置し、増殖させた。
細胞増殖/細胞毒性アッセイ
U937細胞を5,000個/ウェルの密度でコーニング96ウェルマイクロプレートに播種し、37℃、5% CO2で24時間増殖させた。培地の蒸発を最小限に抑え、ウェルや領域間の均等な熱分布を確保するため、ウェルとウェルの間に100~150μLの細胞培養水を加えた。翌日、まずプレートをCloneSelect Imagerでモニターし、0日目のウェルのコンフルエンスデータを作成した後、5-フルオロウラシルでは256.2μMから0.039μM、シスプラチンとオキサリプラチンでは167μMから8.47nMの濃度で、異なる化合物をトリプリケートウェルに3倍希釈系列で添加した。非処理細胞(コントロール)と処理細胞を入れたマイクロプレートを、異なる時点(day1、day2)でCSIにより繰り返し測定し、細胞の成長をモニターし、インキュベーターに戻した。day3では、同じプレートから同じ時点の細胞毒性データを得るため、まず同じマイクロプレートをイメージャーでスキャンし、その後Assay kit #1またはAssay kit #2の「1液」を各ウェルに30μLずつ加え、プレートを37℃で2時間静置した。SpectraMax® ABS Plusマイクロプレートリーダーを用い、吸光度(光学密度、OD)をAssay kit #1では490 nmで読み取り、Assay kit #2では570 nm/605 nmの比で読み取った。
統計解析
CloneSelect Imaager アッセイまたは比色分析で得られたすべてのデータは、細胞を封じ込めたウェルの値から、細胞を封じ込めなかったコントロールウェルの値(バックグラウンド)を差し引くことによりバックグラウンド補正を行った。細胞に対する薬物処理の効果は、以下の式を用いて計算した:細胞生存率(%)=100×サンプル/コントロール。CSIアッセイで測定された薬物効果を推定するため、ウェルコンフルエンスを解析し、アッセイ終了時の非処理細胞(コントロール)を100%生存細胞として相対細胞生存率を算出した:相対細胞生存率(%)=100Xサンプル/コントロール。EC50値は、SoftMax® Pro 7.1ソフトウェア(Molecular Devices社)を用い、非線形回帰4パラメータロジスティックカーブフィットを用いて決定した。EC50は、最大細胞反応の50%を生じる薬物濃度である。
結果
細胞密度の異なる同じウェルをCloneSelect Imaferでイメージングした直後に比色キットでアッセイしたため、CSIアッセイと比色アッセイの結果は直接比較できます。図2では、吸光度のバックグラウンド補正値(アッセイキット)またはウェルのコンフルエンス(CSIアッセイ)とウェルあたりの細胞数をプロットしています。CSI アッセイと比色分析法はいずれも、96 ウェルプレートでウェルあたり 10,000 個からわずか 312 個までの細胞密度を容易に測定できます。
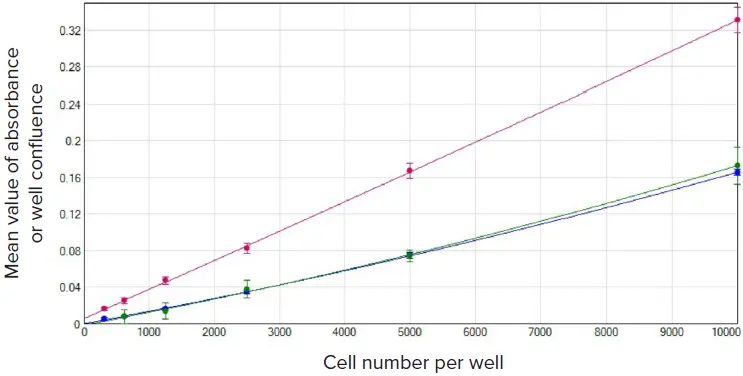
図2. 播種後24時間の幅広い未処理U937細胞の検出比較。吸光度(アッセイキット)またはコンフルエンス(CSIシステム)とウェルあたりの細胞数の平均値を、SoftMax Proソフトウェアの2次曲線フィットを用いてグラフ化した。赤のプロットはアッセイキット#1(r2 = 1.000)、青のプロットはアッセイキット#2(r2 = 1.000)、緑のプロットはCSIアッセイ(r2 = 0.999)。
図3は、薬剤(5-FU)を9種類の濃度でU937セルと72時間インキュベートしたときの用量反応曲線を示している。CSIアッセイの用量反応曲線(緑のプロット)は、別の2つの比色細胞毒性アッセイ(アッセイキット#1および#2)の用量反応曲線と一致していた。すべてのデータは、SoftMax® Proソフトウェアの用量反応4パラメータカーブフィットを用いてプロットした。同様のEC50値は、それぞれ2.2μM(青プロット、Assay kit #2)、3.0μM(緑プロット、CSI assay)、4.7μM(赤プロット、Assay kit #1)であった。
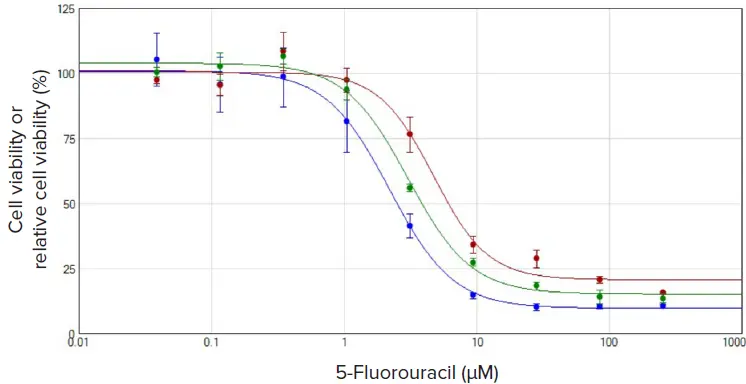
図3. U937細胞を5-フルオロウラシルで72時間処理した場合の用量反応プロットの比較。すべてのプロットは、細胞生存率または非処理細胞で正規化した相対細胞生存率を化合物濃度に対して表示している。データは、SoftMax® Proソフトウェアの用量反応4パラメータカーブフィットを用いてプロットした。赤のプロットはアッセイキット#1、青のプロットはアッセイキット#2、緑のプロットはCSIアッセイ。
別の2種類の白金系抗がん剤シスプラチンとオキサリプラチンも、5-フルオロウラシルと同様の方法で試験された。図4において、CSIは円グラフと数値による直感的なヒートマップを提供し、細胞と72時間インキュベートした後、両白金製剤が示した異なる細胞毒性活性を明らかにした。同じ濃度のシスプラチンとオキサリプラチンで処理した細胞は、U927細胞においてオキサリプラチンがシスプラチンよりも細胞毒性が強いことを示しており、これは他のがん細胞株における知見と一致している4。この結果は、CSIアッセイの直後に同じサンプルで実施された2つの比色分析(アッセイキット#1およびアッセイキット#2)でも確認され(表1)、OxaliplatinのEC50値が低く、細胞毒性が高いことが示された。CSIアッセイで得られた3つの抗がん剤化合物のEC50値は、従来の比色細胞毒性アッセイで得られた値と1~2マイクロモルの範囲内であった。
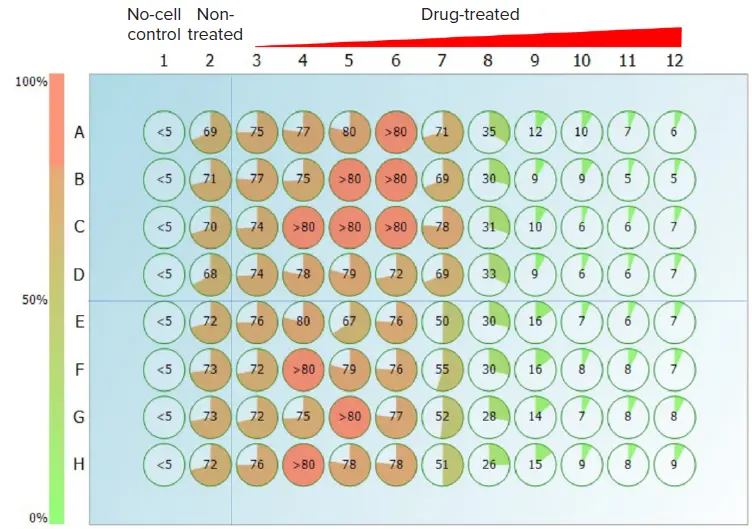
図4. シスプラチン(AからDの行)またはオキサリプラチン(EからHの行)で72時間処理したU937細胞のウェルコンフルエンスの割合。化合物濃度は3列目から12列目まで増加している(左から8.47 nM、25.4 nM、76.2 nM、0.229 μM、0.686 μM、2.06 μM、6.17 μM、18.5 μM、55.6 μM、167 μM)。
| 化合物 | アッセイキット#1 | アッセイキット#2 | CSIアッセイ |
|---|---|---|---|
| 5-フルオロウラシル | 4.7 | 2.2 | 3.0 |
| シスプラチン | 2.3 | 1.6 | 1.6 |
| オキサリプラチン | 1.4 | 0.6 | 0.9 |
表1. 非接着細胞U937を用い、3種類の抗がん剤化合物を72時間培養して得られたEC50(μM)値。
結論
本研究では、CloneSelect Imaferアッセイを、U937細胞に対する3種類の抗がん剤化合物の細胞毒性作用の定量において、広く使用されている2種類の比色吸光度ベースの細胞毒性アッセイと比較しました。3つのアッセイともEC50の結果は非常によく似ていた。しかし、CSIアッセイは、これらの予備的データを得るために、瞬時の全ウェル細胞イメージングとウェルコンフルエンス判定を使用することにより、試薬費ゼロ、インキュベーション時間ゼロ、サンプルハンドリングにかかる作業時間ゼロで、2分未満で細胞に対する薬物効果を標識不要で直接評価することができる。さらに、CSIアッセイでは、サンプリングや薬物治療や進行中の機能アッセイへの介入なしに、複数の時点で繰り返しデータを収集することができる。このラボフリーで非侵襲的な性質は、初期段階の新規化合物スクリーニングや医薬品開発において、ユーザーの時間とコストを節約します。これらの特徴により、CloneSelect Imaagerは、薬剤スクリーニングや薬理学研究における従来の比色細胞毒性アッセイに代わる魅力的なアッセイとなります。
参考文献
- Mosmann T: Rapid Colorimetric Assay For Cellular Growth And Survival- Application To Proliferation and Cyto-Toxicity Assays. J Immunol Methods 1983, 65(1-2):55-63.
- インフルエンザウイルス感染によって誘導されるサイトカイン放出を制御する免疫調節剤をスクリーニングするための細胞モデルとしてのヒトU937細胞株の樹立と検証。Virol Sin. 2019 Dec;34(6):648-661.
- Ghoshal, K., and Jacob, S. T., An alternative molecular mechanism of action of 5-fluorouracil, a potent anticancer drug. Biochem. Pharmacol., 53(11), 1569-1575 (1997).
- Marqués-Gallego, P., den Dulk, H., Backendorf, C. et al. 培養細胞の正確な非侵襲的画像ベース細胞毒性アッセイ。BMC Biotechnol 10, 43 (2010).
PDF版(英語)