Application Note がん患者由来オルガノイドを用いた
疾患モデリング法
- 患者由来細胞を用いた疾患モデリングの実証
- 3D微小組織の化合物処理と処理の自動化
- 癌微小腫瘍に対する化合物効果の解析におけるマルチパラメトリックアプローチを示す
PDF版(英語)
はじめに
Matthew Hammer, Oksana Sirenko | Molecular Devices
Evan F Cromwell | Protein Fluidics, Inc
Margarite Matossian, Matthew E Burow | Tulane University School of Medicine
患者由来の腫瘍組織の使用は、創薬・創標的研究の分野に変革をもたらし、腫瘍生物学を評価するためのトランスレーショナルツールと生理学的に適切なシステムを提供している。ヒトのin vivo環境をより正確に再現し、創薬のためのより予測的なツールであるため、2Dアッセイから3Dセルモデルシステムへの移行が進んでいる。その一例が、腫瘍学研究における患者由来オルガノイド(PDO)の使用である。PDOは腫瘍生検や外科手術から作製され、患者特異的な薬物反応を理解し、がん細胞の増殖を調べるモデルとして役立つ。消化された腫瘍片や患者由来の腫瘍から採取された細胞は、がん幹細胞(CSC)様の性質を示し、何度も継代培養することで元の腫瘍の分子的特徴を維持したオルガノイドを大量に作製することができる1。我々は、患者由来腫瘍TU-BcX-4ICから単離された初代細胞から形成されたPDOを用いた乳癌疾患モデリングの結果を発表する2。TU-BcX-4ICは、希少乳癌のサブタイプである準形成乳癌(MBC)を代表し、組織学的にはトリプルネガティブ乳癌(TNBC)に分類される。この腫瘍は、アドリアマイシン、シクロホスファミド、パクリタキセルによるネオアジュバント療法を併用したにもかかわらず、術前に急速な増殖を示した。PDOを標的抗癌剤の存在下で24-48時間インキュベートし、生存率マーカーまたはE-カドヘリン/CD44マーカーで染色した。我々の実験で観察された化学療法剤に対するPDOの耐性は、患者の腫瘍反応と一致していた。この研究を容易にするため、我々はPu-MAシステムとフローチップを用い、ハイコンテントイメージングと組み合わせた半自動オルガノイドアッセイを行った。マイクロフルイディクスを用いたこの新しいアッセイ法は、生体内条件を模倣した3次元細胞ベースアッセイ培養の自動化を可能にし、幅広いアッセイ検出様式を可能にする。ここで述べた研究は、構造的にデリケートな3Dシステムを試験するin vitro創薬研究におけるPu-MAシステムの有用性を示すものであり、すべての固形腫瘍タイプに適用可能である。
Pu-MAシステムアッセイ
Pu-MAシステムフローチップは、便利なマルチウェルプレートフォーマット(384ウェル間隔)に配置されたチャンバーとリザーバーで設計されており、プレートあたり最大32のオルガノイドサンプルを提供します。腫瘍細胞と試薬がフローチップにロードされると、プレートはPu-MAシステムにセットされ、保護されたサンプルチャンバーに接続されたマイクロ流路を通して試薬交換が自動的に行われる3。
複数の試薬交換は、内蔵プログラムを用いてアッセイプロトコルと一緒に実行される。アッセイプロトコルはシステムにあらかじめロードされ、直感的なタッチスクリーンインターフェースを使用して実行されます。Pu-MAシステム全体をインキュベーター内に設置し、37℃、CO2でアッセイを実行することができる(図1)。システム構造と液体を移動させるための空気圧の使用により、サンプルチャンバーへのガス交換が行われ、セルの健康が維持される。

図1. ハイコンテント3Dイメージングと組み合わせた半自動腫瘍アッセイワークフローの概略図。

インストゥルメンテーション
Pu-MAシステムと3Dフローチップの特徴:
- 細胞を保護したチャンバー内で培地交換を自動化
- 細胞の分泌をモニターするために上清を回収可能
- 高感度メタボロームプロファイリングのために、細胞をその場で溶解可能
- スフェロイドをフローチップ内で画像化したり、サンプルを取り出してイムノアッセイやメタボロミクス解析が可能
アッセイプロトコルはPu-MAシステムソフトウェアで編集可能です。
ImageXpress® マイクロコンフォーカルハイコンテンツイメージング
システム内容
- 5色+透過光
- 環境制御
- 自動データ解析
システムはMetaXpress® ハイコンテント画像取得・解析ソフトウェアにより制御されます。
腫瘍塊の形成と染色
- 原発腫瘍由来のTU-BcX-4ICセルから腫瘍様突起が形成された。この腫瘍は、アドリアマイ シン、シクロホスファミド、パクリタキセルを併用したネオアジュバント療法にもかかわらず、術前に急速 な増殖を示した。
- 4ICセルを腫瘍様体1個当たり2,000個ずつ分注し、72時間培養し、緊密な腫瘍様体を形成させた。2 腫瘍は磁性ナノ粒子4 (ナノシャトル(NS)、グレイナー・バイオワン社製)でコーティングされ、Pu-MAシステムフローチップへの球の分注と配置を補助した(図2)。
- 図 4 に示すように、Pu-MA システムを用いて腫瘍細胞を半自動的に処理・染色した。このシステムは生存率と免疫蛍光染色の両方に使用できる。
- 腫瘍細胞を化合物で処理し、細胞生存能マーカーで染色し、ImageXpress® Micro Confocalシステムでイメージングした(図3)。画像スタックを解析し、生細胞(カルセインAM陽性)と死細胞(EthD-1陽性)の割合を求めた(図6)。5

図2. 上:腫瘍形成のワークフロー。下: 腫瘍体の磁気標識と位置決めのプロトコルの概略図。右側に腫瘍体の透過光画像を示す。ナノシャトル粒子による光学的アーチファクトはなく、腫瘍はウェル内の中央に位置している。
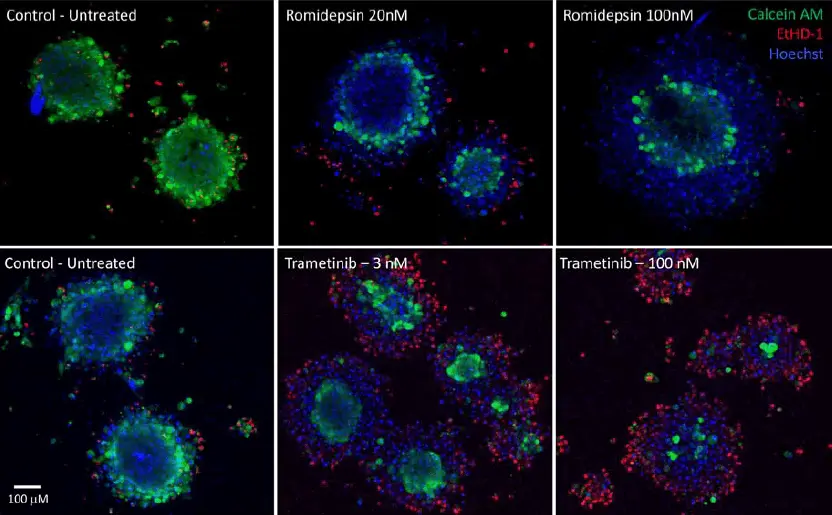
図3. ロミデプシン(上)とトラメチニブ(下)で治療した腫瘍の画像。画像は10倍の対物レンズで取得した共焦点スタックの最大投影。
マイクロ流体フローチップ技術
各Pu-MAシステムフローチップには、マイクロ流路で接続された8レーンの試薬ウェルが封入されています。4つのフローチップは384マルチウェルプレートフォーマットの全ウエルを配置するプレートホルダーにセットされ、1アッセイあたり32サンプルに対応します。各レーンの化合物ウェルには、培地、化合物、または追加のアッセイ試薬を入れる。腫瘍細胞はサンプルウェルに入れられ、ウェル底部の保護されたチャンバーに設置される。これにより、微小組織を乱したり乾燥させたりすることなく、試薬をサンプルウェルに出し入れすることができる。
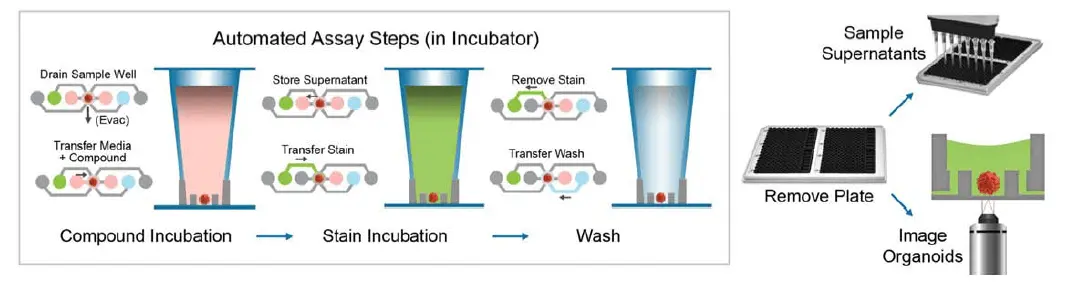
図4. 腫瘍細胞を化合物で一晩処理した後、生存率色素(1μM calcein AM、3μM EthD-1、33μM Hoechst 33342)またはE-カドヘリンとCD44に対するFL標識一次抗体(BD Biosciences)で染色した。コンディショ ニングメディウムは、追加解析のために除去することができる。
がん疾患モデリング
- ・TU-BcX-4IC球をNCI60パネルのがん治療薬から3種類の化合物で24時間または48時間処理した:
・ロミデプシン-ヒストン脱アセチル化酵素(HDAC)阻害剤
・Trametinib:MEK1およびMEK2活性の選択的可逆的アロステリック阻害剤。
・パクリタキセル - 微小管伸長を阻害する有糸分裂阻害剤 - スフィアをPu-MAシステムで生存率と細胞表面バイオマーカーで染色し、ImageXpress® Micro Confocalシステムでイメージングした(図5)。画像スタックを解析し、生細胞率(CD44陽性)を求めた(図6)。
- パクリタキセルに対する腫瘍細胞の不感受性は、患者の腫瘍の臨床像と一致していた。
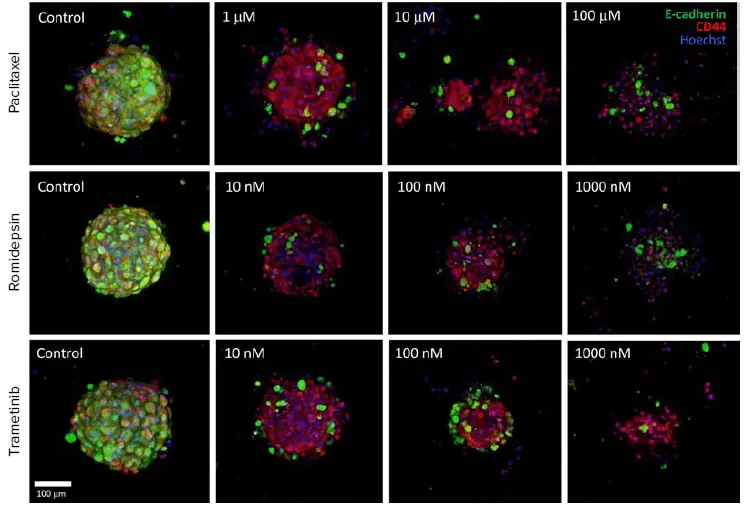
図5. 化合物と24時間インキュベートし、E-カドヘリン(緑)とCD44(赤)を標識した腫瘍。画像は20X水浸対物レンズで撮影した共焦点スタックの最大投影。処理によりE-カドヘリンは消失し、オルガノイドは破壊された。EC50値はCD44陽性細胞の割合で測定した。
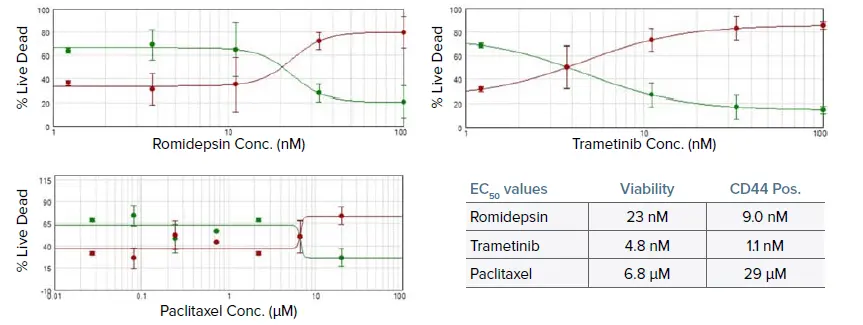
図6. ロミデプシン、トラメチニブ、パクリタキセルで治療した腫瘍細胞の生存率アッセイによる濃度反応曲線。EC50値は生存率とCD44染色の両方から表に示した。ロミデプシンとトラメチニブの値は正常範囲内であったが、パクリタキセルは有意に高かった。これは患者の腫瘍の治療に対する反応と一致している2。
結論
- 我々は、インキュベーター環境で3D細胞モデルを用いて複雑なプロトコルを実行する、新規の半自動腫瘍アッセイシステムの能力を実証した。
- 原発性腫瘍に由来する患者由来の腫瘍細胞を、細胞表面マーカーの高解像度共焦点イメージングと細胞生存率染色(Live/Dead)を用いて、化合物応答についてアッセイした。
- 毒性情報を取得し、機能的アッセイを行うために、腫瘍組織やオルガノイドをin situで解析する能力は、疾患モデリングに大きな可能性を示している。
参考文献
- 新しいトリプルネガティブ乳癌患者由来異種移植モデルを用いた薬剤耐性プロファイリング Matossian, M.D. et al (2019) 19(1): 205, BMC Cancer
- 準形成乳癌の新しい患者由来異種移植片モデルの詳細な特性解析により、希少腫瘍型における実行可能な生物製剤標的およびマトリックス進化のパターンを同定する。Matossian, M.D. et al (2021) Clin. 腫瘍学(改訂中)
- 新規フローチップシステムとハイコンテントイメージャーを用いた3D細胞ベースアッセイによる疾患モデリング。Cromwell, E.F. et al (2021) 26(3): 237, SLAS Technol.
- 磁気細胞浮遊に基づく三次元組織培養。Souza, G.R. et al (2010) 5(4): 291, Nat. Nanotechnol.
- 3次元癌スフェロイド培養の生存率と形態を特性化するハイコンテントアッセイ。Sirenko, O. et al (2015) 13, 402, Assay and Drug Dev. Tech.
PDF版(英語)