Application Note SpectraMax M5、LMax II384および
Analyst GTマイクロプレートリーダーを用いた
Dual-Glo Luciferaseレポーター遺伝子アッセイ
PDF版(英語)
マイケル・スー、ジンファン・リャオ医学博士、エブリン・マクガウン博士、モレキュラー・デバイス社、1311オーリンズ博士、サニーベール、カリフォルニア州94089号

はじめに
レポーター遺伝子アッセイは真核生物の遺伝子発現の研究に用いられる。培養細胞の一過性トランスフェクションでは、細胞数、生存率、トランスフェクション効率の違いによる実験のばらつきを最小化するために、二重遺伝子レポーターが一般的に使用される。実験レポーター遺伝子を含むプラスミド(制御プロモーターと結合)を、コントロールレポーター遺伝子を含む第二のプラスミド(構成プロモーターと結合)と共導入する。ホタルとレニラのルシフェラーゼを用いた生物発光レポーター系は、どちらも簡便で高感度であるため、共レポーターとして広く用いられている。これまでのルシフェラーゼレポーターアッセイは、試薬添加後数秒以内に読み取らなければならない「フラッシュ」アッセイであり、ルミノメーターに統合されたインジェクターが必要であった。(Maxline App Note #39参照)。最近、プロメガ社はハイスループット分析用のDual-Glo Luciferaseアッセイシステムを発表した。シグナルは試薬添加後2時間安定で、インジェクターは不要である。
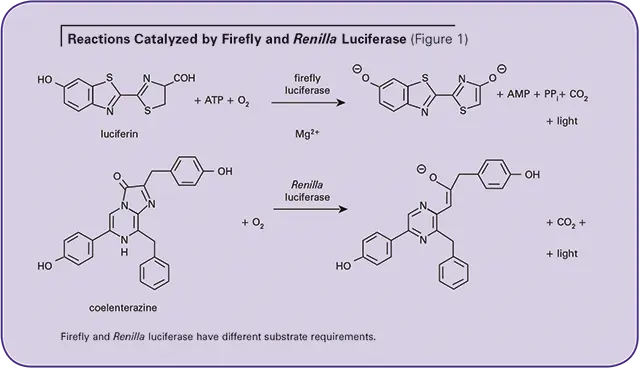
図1は2つの酵素反応を示している。ホタルルシフェラーゼ酵素はルシフェリンの酸化を触媒し、同時に光を放出する1。この反応にはATP、Mg2+、O2が必要である。レニラ・ルシフェラーゼは、O2依存的なコエレンタゼルのルシフェリン(コエレンタジン)の酸化を触媒するが、Mg2+やATPは必要としない。2両酵素は基質要求性が異なるため、単一の反応混合物で測定できる。どちらの反応も、Molecular Devices社のマイクロプレートルミノメーターで簡単に測定できる。以下に、LMax™ II384 専用最高級マイクロプレートルミノメーター、Analyst® GT マルチモード、フィルターベース装置、SpectraMax® M5 マルチ検出、モノクロメーターベースリーダー(トップリードとボトムリードの両方が可能)の結果の例を示す。
材料
Dual-Glo ルシフェラーゼアッセイシステム(Promega Cat.#E2920)
Quantilum 組換えホタルルシフェラーゼ(Promega Cat.#E1720)
レニラ・ルシフェラーゼ(Chemicon Cat.#4400)
保存バッファー、25 mM Tris-acetate、1 mM EDTA、1 mM DTT、0.2 M NH4SO4、15% グリセロール、30% エチレングリコール、0.1% BSA
標準バッファー、リン酸緩衝生理食塩水pH7.4(PBS)+0.01%BSA
細胞株 CHO-K1 (ATCC Cat. #CCL-61)
ホタルルシフェラーゼプラスミド:pGL3-control vector (Promega Cat. #E1741) および PCRELuc (BD Biosciences Cat. #631911)
レニラルシフェラーゼプラスミド:phRL-TKベクター(Promega Cat. #E6241)
リポフェクタミン(Invitrogen Cat. #10378-016)
Opti-Mem (インビトロジェン社製 Cat. #31985-070)
SpectraMax M5 Multi-Detection Microplate Reader、Analyst GT Multimode Microplate Reader、LMax II384 Luminescence Microplate Reader (Molecular Devices)
方法
ストックスタンダードの調製
ステップ 1. ホタルルシフェラーゼ標準品(1.0 mg/mL)は、プラスチックバイアル中の標準バッファー4.2 mLにホタルルシフェラーゼ14.9 mg/mLストック0.3 mLを加えて調製した。その後、1.0 mg/mL の標準液を 0.5 mL のアリコートに分け、必要 になるまで-70℃で保存した。
ステップ2. 1.0mg/mLのホタルルシフェラーゼ10μLを990μLの標準バッファーに移すことにより、1日分の実用ホタルルシフェラーゼ(10μg/mL)を調製した。
ステップ3. レニラルシフェラーゼ(10μg/mL)を、10μgのレニラルシフェラーゼを含むレニラルシフェラーゼボトルに990μLの標準バッファーを加えることにより調製した
ホタルおよびレニラルシフェラーゼ標準物質の調製
ステップ1. それぞれのルシフェラーゼ標準物質10μLをプラスチックバイアル中の標準バッファー980μLに移すことにより、複合ルシフェラーゼストック標準物質(それぞれ100ng/mL)を調製した。
ステップ2. 10ng/mLから10fg/mLになるように標準緩衝液で10倍希釈し、複合標準曲線を作製した。
試薬の調製
Dual-Glo 試薬と Dual-Glo Stop & Glo 試薬はキットの説明書に従って調製した。
ルシフェラーゼ標準物質を用いたアッセイ手順
アッセイプレートは、25μL/ウェルのホタル/レニラルシフェラーゼ標準品とブランクを組み合わせたものを、Costar 384ウェル白色プレートに6反復でピペッティングして調製し、次いで25μL/ウェルのDualGloルシフェラーゼ基質溶液を各ウェルに添加した。プレートをプレートシェーカーで軽く混合し、暗所、室温で10分間インキュベートした後、ホタルルシフェラーゼ活性を測定した。キットの添付文書によると、ホタルルシフェラーゼの発光シグナルは2時間比較的安定で、その間に最初の発光シグナルの60%以上が保持される3。ホタルルシフェラーゼを測定した後、DualGlo Stop & Glo基質溶液(25μL/ウェル)を各ウェルに加え、ホタルルシフェラーゼ反応をクエンチし、レニラルシフェラーゼ反応の基質とした。プレートを短時間撹拌し、暗所、室温で10分間インキュベートし、再度読み取った。レニラ・ルシフェラーゼの発光シグナルも2時間は比較的安定している3。
細胞ベースのアッセイ
CHO-K1細胞を2 x 106/100 mmプレートの密度で一晩播種し、標準的なLipofectamineトランスフェクション・プロトコールに従って、pGL3-対照ベクターとphRL-TKベクター(DNA合計6μg;pGL3とphRL-TKの比率=50:1)を一過性にトランスフェクトした。pGL3-コントロールベクターは、SV40プロモーターによって発現が駆動されるホタルルシフェラーゼをコードするcDNAを含む。24時間後、細胞をCostar白壁/透明底384ウェルプレートに0~25,000細胞/ウェルの密度で25μLに一晩播種した(n=6/グループ)。翌日、Dual-Gloルシフェラーゼ基質溶液を加えた(25μL/ウェル)。プレートを短時間攪拌し、暗所、室温で10分間インキュベートし、細胞の溶解と酵素の平衡化を完全に行った。その後、ホタルルシフェラーゼ活性を測定した。ホタルルシフェラーゼの測定後、Dual-Glo Stop & Glo 基質溶液(25 μL/ウェル)を各ウェルに加え、ホタルルシフェラーゼ反応をクエンチし、レニラルシフェラーゼ反応の基質とした。プレートを短時間撹拌し、暗所、室温で10分間インキュベートし、再度読み取った。
フォルスコリンおよび8-Br-cAMPによるpCRE-luc(cAMP応答エレメント)の誘導を測定するために、CHO-K1細胞を2×106/100mmプレートの密度で一晩播種し、標準的なLipofectamineトランスフェクションプロトコールに従ってpCRE-lucおよびphRL-TKベクター(DNA合計6μg;pCRE-luc対phRLTK比=50:1)で一過性にトランスフェクトした。トランスフェクションの24時間後、細胞をCostar白色壁/透明底96ウェルプレートに100μL(60,000細胞/ウェル)で一晩播種し、50μMフォルスコリンまたは1mM 8-Br-cAMPで6時間処理した(コントロール=未処理)。ホタル(pCRE-Luc)およびレニラ(phRL-TK)ルシフェラーゼ活性は、Dual-Gloアッセイシステムを用いて測定した。
装置の設定
SpectraMax M5 マイクロプレートリーダー:
Read type = endpoint, Read Mode = luminescence with 1000 ms integration time, Wavelengths = All, Automix = off, Auto calibration = on, Settling time = off, Autoread = off.
LMax II384 マイクロプレートルミノメーター: 積分時間 = 1秒、セットリング時間 = オフ、Autoread = オフ。
Analyst GTマイクロプレートリーダー: 発光高さ=1 mm、最大積分=1,000,000 μ秒、ウェルあたりの目標CV=1.0%、生データ単位=カウント/秒、減衰モード=アウト。
データ解析
データの解析と表示には、Molecular Devices SoftMax® Proソフトウェアを使用した。検出下限(LLD)は、ブランクの正の標準偏差3以上検出可能なルシフェラーゼのレベルと定義した。
結果
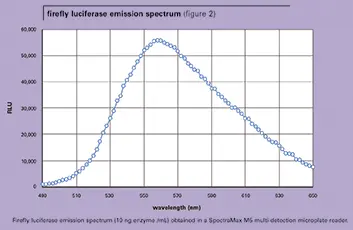
ルシフェラーゼの発光スペクトル
図2にSpectraMax M5で得られたホタルルシフェラーゼの発光スペクトルを示す。発光λ極大は、文献で報告されているように560 nmであった。レニラ・ルシフェラーゼの発光λ極大は約480 nmである(データは示さず)。
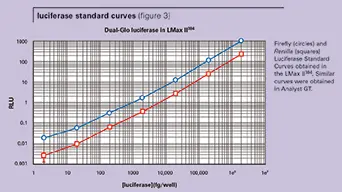
ルシフェラーゼ標準曲線
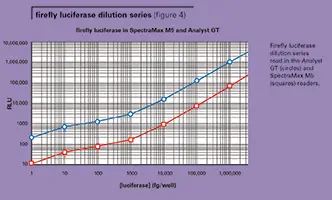
図 3 に、LMax II384 の 384 ウェルプレートで得られた代表的なホタルおよびレニ ラのルシフェラーゼ標準曲線を示す。ホタルのルシフェラーゼシグナルは、レニラのシグナルよりも一桁大きかった。この実験では、LMax II384 と Analyst GT システムの両方で、ホタルとレニラのルシフェラーゼの検出下限 (LLD) はそれぞれ 2 fg/ ウェルと 20 fg/ ウェルであった。図 4 は、SpectraMax M5 と Analyst GT を用いて 96 ウェルプレートで測定したホタルルシフェラーゼの希釈系列を示しています。典型的なLLDは、Analyst GTでは約1~2 fg/ウェル、SpectraMax M5では約2~3 fg/ウェルでした。アッセイのダイナミックレンジは約5桁でした。
細胞を用いた実験
最初の実験では、pGL3-対照ベクターとphRL-TKベクターを一過性にトランスフェクトしたCHO-K1細胞の希釈系列を調製した。細胞を384ウェルプレートに0から25,000細胞/ウェルの密度で一晩播種し、ホタルおよびレニラ・ルシフェラーゼ活性をLMax II384(図5)およびAnalyst GT(データは示さず)で測定した。どちらの装置でも、ホタルルシフェラーゼ活性の推定 LLD は 25 cells/well であり、LLD の Z' factor は同程度であった(LMax II では 0.52、Analyst GT では 0.58)。SpectraMax M5でも同様の結果が得られますが、これらの実験はSpectraMax M5が発売される前に行われたものです。
注:Dual-Glo試薬は細胞を溶解し、酵素を溶液中に放出するので、発光測定は基本的に溶液中の精製酵素と同じである。Spectramax M5はAnalyst GTやLMax II384と同様の検出能力を持つ(図4)ので、細胞溶解液中の酵素を測定する場合も同様の性能であると確信している。
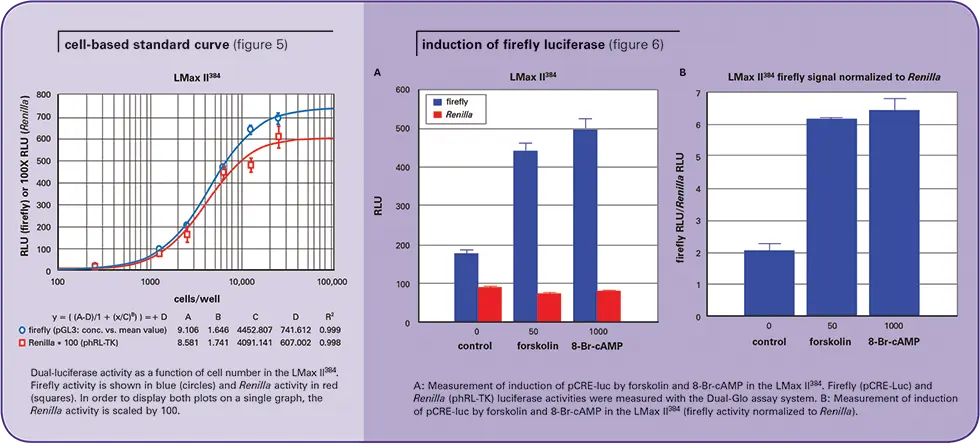
次の実験の目的は、フォルスコリンと 8-Br-cAMP による pCREluc の誘導を測定するために Dual-Glo アッ セイシステムを使用できることを実証することであった。図 6 のパネル A は、LMax II384 を用いて Dual-Glo アッ セイシステムで測定したホタルおよびレニラルシフェラーゼ活性を示す。フォルスコリンと8-Br-cAMPによるホタルルシフェラーゼ活性の顕著な誘導は明らかである。予想通り、レニラ活性にはほとんど影響がない。同様の結果がAnalyst GTでも得られた。
図6のパネルBは、ホタル活性をレニラ活性に正規化(すなわち、ホタル活性とレニラ活性の比)した後の同じ結果を示している。ホタル活性の誘導は約3倍であり、両装置のZ'因子は、50μMのフォルスコリンと1mMの8-Br-cAMPでそれぞれ0.64と0.62であった。
考察と結論
上記の結果から、Molecular Devices社製マイクロプレートルミノメーター3機種すべてにおいて、優れた検出下限とダイナミックレンジが明らかになった。96ウェルプレートと384ウェルプレートの検出下限(LLD)は、LMax II384とAnalyst GTではホタルルシフェラーゼで < 2 fg/ウェル、SpectraMax M5では2-3 fg/ウェルであった。レニラ・ルシフェラーゼの発光はホタルよりはるかに弱いため、そのLLDは10倍高い。
一過性にトランスフェクトしたCHO-pGL3-luc-phRL-TK細胞におけるホタルルシフェラーゼ活性のLLDは25cells/wellであった(LMax II384とAnalyst GTのZ'ファクターはそれぞれ0.58と0.52)。SpectraMax M5 についても、精製酵素を用いたいくつかの実験結果に基づけば、結果は同様であろう(例えば、図 4)。上記で指摘したように、Dual-Glo試薬を添加すると、細胞は溶解し、酵素は酵素標準製剤と同様に、実際の発光測定中に溶液中で遊離する。
この装置では、一過性にトランスフェクトした CHO-pCRE-luc-phRLTK 細胞で、フォルスコリンと 8-Br-cAMP によって誘導された pCRE-luc 活性も簡単に検出できます(Z' ファクターは、フォルスコリンと 8-Br-cAMP でそれぞれ 0.64 と 0.62 でした)。
LMax II384 は、専用の最高級マイクロプレートルミノメーターです。一流のラボで必要とされる感度、柔軟性、自動化機能、バリデーションツールを備えており、ハイスループットのアプリケーションに適しています。デュアルリキッドインジェクターを搭載した LMax II384 は、フラッシュおよびグロー発光検出アプリケーション用に設計されています。超高速フォトンカウンティング技術により、優れた信号対雑音比を実現しています。LMax II384 は、ロボットシステムと統合することができます。
Analyst GT は、ルミネセンス検出用の独立した光学系と光電子増倍管を含む、卓越したマルチモードアッセイ検出性能を提供します。専用のルミネッセンス光電子増倍管は、バックグラウンドが極めて少なく、青色波長域で優れた性能を発揮します。Analyst GTは、双方向スタッカーに20プレートマガジンを装備しています。
SpectraMax M5は、トップリードとボトムリードの両方の機能を備えたマルチ検出モノクロメーターベースのリーダーである。波長スキャン機能だけでなく、専用ルミノメーターに匹敵するルミネセンス性能も備えている。
参考文献
1. M.A. DeLuca and W.D. McElroy. (1978) in Meth Enzymol 53巻; p. 3.
2. J.C. Matthews, et al. (1977) Renilla reniformisルシフェラーゼの精製と性質。Biochemistry, 16:58.
3. Promega, Dual-Glo luciferase assay system technical manual, www.promega.com.
PDF版(英語)