Application Note SpectraMax i3xマルチモードマイクロプレートリーダーと
SpectraMaxインジェクターカートリッジを用いた
デュアルルシフェラーゼレポーター(DLR)アッセイ
- 6桁のリニアレンジでルシフェラーゼ活性を高感度に定量
- SoftMax Proソフトウェアによる自動データ解析と正規化レポーター活性の計算
- SmartInject™テクノロジーによる試薬混合と最適な結果
PDF版(英語)
はじめに
レポーター遺伝子アッセイは、真核生物遺伝子の発現を研究するために用いられる。デュアルレポーター遺伝子アッセイでは、セルは2つのベクターでトランスフェクトされる。1つ目は目的の制御プロモーターに結合した実験レポーター遺伝子を含み、2つ目は構成プロモーターに結合したコントロールレポーター遺伝子を含む。実験レポーターの活性をコントロールレポーターに対して正規化することで、実験のばらつきを最小限に抑えることができる。
ホタルとレニラのルシフェラーゼを用いた生物発光レポーターシステムは、どちらもアッセイが簡単で感度が非常に高いため、共同レポーターとして広く使用されている。プロメガ社の DLR (Dual-Luciferase® Reporter) アッセイシステムは、ホタルとレニラの両方のルシフェラーゼ活性を一つのマイクロプレートウェルで測定することができ、ホタルは実験レポーターとして、レニラはコントロールとして機能します。図1は、同じアッセイウェル内で順次起こる2つの酵素反応を示している。ホタルルシフェラーゼ酵素はルシフェリンの酸化を触媒し、同時に光を放出する。レニラ・ルシフェラーゼは、O2依存的なコエレンタ ルシフェリン(コエレンタジン)の酸化を触媒するが、Mg2+や ATPは必要としない。
DLRアッセイでは、異なる基質を封じ込めた2種類の試薬をそれぞれ分注し、発光を読み取る必要がある。このアプリケーションノートでは、組換えホタルおよびレニラ ルシフェラーゼのリニアダイナミックレンジが 60 年、ルシフェラーゼをトランスフェクトした細胞のリニア検出がウェルあたり 195 ~ 25,000 個であることを実証しています。
材料
- Dual-Luciferase Reporter Assay System (Promega cat. #E1960);内容は以下の通り:
◦iferase Assay Buffer II
◦ルシフェラーゼアッセイ基質
◦Stop & Glo Buffer
◦Stop & Glo 基質
◦5X Passive Lysis Buffer(パッシブ溶解バッファー - 精製リコンビナントルシフェラーゼ酵素
◦ホタルルシフェラーゼ QuantiLum ® Recombinant Luciferase (Promega cat. #E1701)
◦レニラ・ルシフェラーゼ 組換えレニラ・ルシフェラーゼ(RayBiotech cat.) - CHO-K1セル (ATCC cat. #CCL-61)
- コントロールルシフェラーゼベクター
◦pGL4.13[luc2/SV40] ホタルルシフェラーゼベクター (Promega cat. #E6681)
◦pGL4.74[hRluc/TK] レニラルシフェラーゼベクター (Promega cat. #E6921) - FUGENE HDトランスフェクション試薬 (Promega cat. #E2311)
- 6ウェル組織培養プレート (Corning cat. #3516)
- 96ウェルフラットクリアボトム白色TC処理マイクロプレート (Corning cat. #3610)
- BrightMax シーリングフィルム(Genesee 社、カタログ番号 12-639)
- 96ウェルおよび384ウェルの白色マイクロプレート(Greiner cat.)
- SpectraMax i3x マルチモードマイクロプレートリーダー
- SpectraMax インジェクターカートリッ
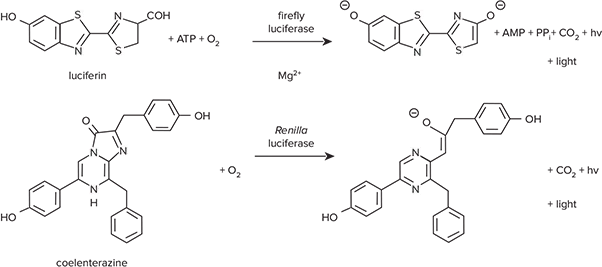
*図1. ホタルと*レニラ・ルシフェラーゼが触媒する反応。ホタルとレニラ・ルシフェラーゼは異なる基質を必要とする。
方法
酵素標準曲線
ホタルルシフェラーゼのストック溶液は、12.4 mg/mL の溶液を、1 mg/mL の BSA を封入した 1X Passive Lysis Buffer(PLB、Dual-Luciferase Reporter Assay System のコンポーネント)で 1 mg/mL に希釈して調製した。ストック・レニラ・ルシフェラーゼは、凍結乾燥した酵素を1X PBSで1mg/mLの濃度に再構成することにより調製した。
ホタルおよびレニラルシフェラーゼの作業溶液(10 µg/mL)は、ストック溶液(1 mg/mL)10 µLを990 µLのPLBに移すことにより作製した。次に、それぞれのルシフェラーゼ原液10 µLを980 µL PLBに移し、複合ルシフェラーゼ原液標準液(各100 ng/mL)を調製した。このストックスタンダードを1:10に連続希釈し、100 fg/mL~100 ng/mL(1.6 fM~1.6 nM)の濃度のスタンダードを得た。Luciferase Assay Reagent II (LAR II) と Stop & Glo Reagent は、Dual-Gloiferase Reporter Assay System テクニカルマニュアルに従って調製した。
SpectraMax インジェクターカートリッジのインジェクター 1 に LAR II 260μL を、インジェクター 2 に Stop & Glo 試薬 260μL を注入した。SoftMax ProのAcquisition Viewを使用して、インジェクションによるプレートの読み取りを設定しました(図2)。どちらのインジェクターも、SmartInject Technologyを使用して100µL(96ウェルプレート)または25µL(384ウェルプレート)の試薬を供給するように設定されました。SmartInject Technologyは、試薬を完全に混合するためにプレートの振とうと注入を組み合わせ、2秒間の遅延と10秒間の積分を行います。20μL(96ウェルプレート)または10μL(384ウェルプレート)のルシフェラーゼスタンダードをアッセイウェルにプレーティングした。アッセイプレートを SpectraMax i3x リーダーのプレート引き出しにプレーティングし、読み取りを開始した。データ解析とグラフ化はSoftMax Proソフトウェアを用いて行った。あらかじめ設定されたDual-Luciferase Reporter Assayプロトコルは、SoftMax Proプロトコルライブラリに含まれている。
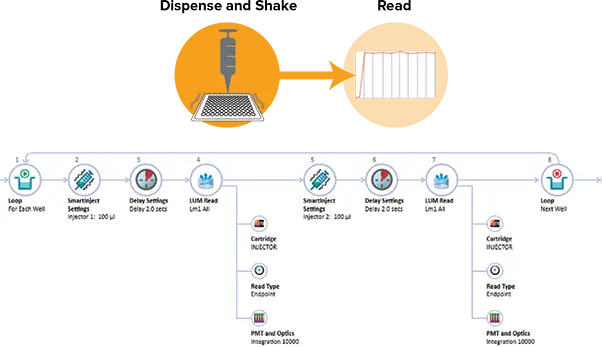
図2. DLRの採 取プラン。SoftMax ProのAcquisition Planエディタを使用すると、各ウェルに適用する操作をドラッグ&ドロップでセットアップできます。上図はDLRアッセイのセットアップです。2つの別々の注入および読み取りステップが適用されています。サンプル取得プランの上の図に描かれているSmartInjectは、注入と2秒間の遅延ステップの間に振とうを可能にし、試薬が完全に混合され、シグナルがウェル間で迅速かつ一貫して発現するようにします。
細胞ベースアッセイ
CHO-K1細胞を6ウェル培養プレートに1ウェルあたり2.5x105細胞でプレーティングし、一晩接着増殖させた。翌日、FUGENE HDトランスフェクション試薬の標準プロトコールに従って、細胞をpGL4.13[luc2/SV40]ホタルルシフェラーゼベクターおよびpGL4.74[hRluc/TK]レニラルシフェラーゼベクターで一過性にトランスフェクトした。ホタルとレニラのベクターDNAの比率は10:1であった: レニラベクターDNAを使用し、各ウェルに合計1μgのDNAと3μLのFUGENE HDトランスフェクション試薬を投与した。
トランスフェクションの24時間後、細胞を96ウェル平板クリアボトム白色TC処理マイクロプレートに、1ウェル当たり195~25,000細胞の密度で播種し、一晩増殖させた。その後、1X Passive Lysis Bufferで細胞を溶解し、Dual-Luciferase Reporter Assay SystemとSpectraMax i3xリーダー(インジェクターカートリッジ付き)を用いて、同じプレートでアッセイした。アッセイに先立ち、発光アッセイシグナルを最大限に検出するため、マイクロプレートの底にソリッド白色プレートシールを貼付した。
結果
ルシフェラーゼ標準曲線
ホタルとレニラのルシフェラーゼのシグナルは、1.6 fMから1.6 nMまで、テストした酵素の6十 分な範囲にわたって直線的であった(図3)。96ウェルプレートでは、これは1ウェル当たり1fgから1ngに相当し、384ウェルプレートでは0.5fgから0.5ngに相当する。96ウェルと384ウェルのどちらのアッセイフォーマットでも、同様の直線性とダイナミックレンジが得られ、デュアルルシフェラーゼアッセイとSpectraMax i3xシステムがどちらのフォーマットにも適していることが示された。
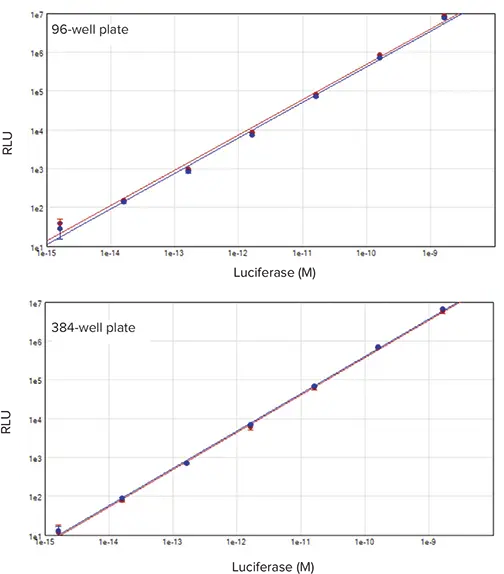
図3. 96ウェルおよび384ウェルデュアルルシフェラーゼ標準曲線。精製した組換えホタル(赤プロット)およびレニラ(青プロット)ルシフェラーゼの1:0希釈系列を、DLRシステムを用いてアッセイした。60年間の直線範囲が測定された(r2 = 0.994)。上は96ウェルフォーマット、下は384ウェルフォーマット。
細胞ベースアッセイ
ホタルとレニラの両ルシフェラーゼのシグナルは、195~25,000細胞/ウェルという幅広い細胞密度で直線性を示した(図4)。両酵素間の発光シグナルの大きさの違いは、ホタルの比率が10:1であることによる: 細胞のトランスフェクションに用いたレニラベクターと、SV40(ホタルベクター)とTK(レニラベクター)のプロモーターの強さが異なるためである。
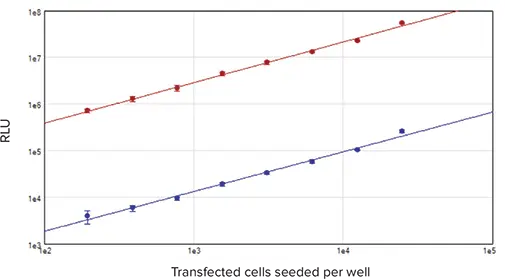
図4. セルベースの標準曲線。ホタルおよびレニラの両ルシフェラーゼでトランスフェクトしたセルを96ウェルプレートに1ウェル当たり195~25,000個の密度で播種し、DLRシステムを用いてアッセイした。結果はRLU対ウェルあたりのトランスフェクション細胞数でプロットした。赤のプロットはホタルルシフェラーゼシグナル、青のプロットはレニラルシフェラーゼシグナル(両者ともr2 = 0.99)。
図5は、ホタルルシフェラーゼのRLU値をレニラ・ルシフェラーゼのRLU値で正規化したものである。正規化された値は、試験された細胞密度の全範囲で同様であった。
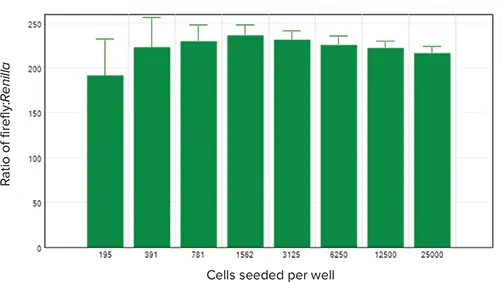
*図5. トランスフェクト細胞のホタルルシフェラーゼシグナルを*レニラルシフェラーゼシグナルに対して正規化し、その正規化値をウェルあたりの播種細胞数に対してグラフ化した。
結論
上記の結果は、ホタルとレニラのルシフェラーゼについて、1 ウェルあたり 1 fg 未満という優れた感度と、6 デシベルのダイナミックレンジを実証しており、ルシフェラーゼの 発現レベルと細胞密度の広範囲にわたって、ルシフェラーゼシグナルの正確 な測定を保証している。
SpectraMax i3xリーダーは、冷却光電子増倍管(PMT)を搭載し、発光のバックグラウンドノイズを低く抑えている。SpectraMaxインジェクターカートリッジと組み合わせて使用すると、このシステムは、卓越した感度とダイナミックレンジで、レポーター遺伝子やその他のアッセイを含む豊富なフラッシュタイプの発光アプリケーションを可能にする。解析は、各ルシフェラーゼ値を表示し、結果の解釈を容易にするために正規化された比率を計算する、事前に設定されたSoftMax Proプロトコルを使用して迅速に行われます。
参考文献
- DeLuca, M.A. and W.D. McElroy (1978) in Meth. Enzymol., 53:3.
- Matthews, J. C. et al. (1977). Purification and properties of Renilla reniformis luciferase. Biochemistry, 16:58.
- https://www.promega.com/products/pm/ dlready-luminometers/dlready-validatedluminometers
SpectraMax i3x Multi-Mode Detection Platformの詳細はこちら >>
PDF版(英語)