Application Note SpectraMax i3x マルチモード検出プラットフォーム上の
EarlyTox Caspase-3/7 NucView 488アッセイキット
- 蛍光マイクロプレートリーダーおよび蛍光イメージャーに最適化
- 試薬添加のみのシンプルなワークフロー
- バックグラウンド蛍光を低減するマスキング試薬(オプション
PDF版(英語)
はじめに
アポトーシスは、胚発生などの正常な過程だけでなく、癌や神経変性疾患などの疾患においても、細胞のプログラム死を引き起こす重要なメカニズムである。アポトーシスのアッセイは、様々なイメージングリーダーやマイクロプレートリーダーを用いて行うことができ、正常および疾患に関連した細胞死のメカニズムに関する貴重な情報を提供します。
EarlyTox™ Caspase-3/7 NucView™ 488アッセイキットは、NucView 488 Caspase-3基材を使用することにより、インタクトな細胞集団におけるアポトーシスの検出を可能にします。この基質は、カスパーゼ-3/7 DEVD認識配列に結合した蛍光性DNA色素から構成されています。最初は蛍光を発しないが、細胞膜を透過し、細胞がアポトーシス状態であれば、基材はカスパーゼ-3/7によって切断され、核に入りDNAに結合する色素を放出し、明るい緑色の蛍光を発する。
多くの蛍光ベースのアポトーシスアッセイは、顕微鏡またはイメージングシステムでの使用にのみ最適化されているが、EarlyTox Caspase-3/7 NucView 488アッセイはその両方に最適化されている。ここでは、SpectraMax® MiniMax™ 300イメージングサイトメーターまたはSpectraMax® i3x マルチモードマイクロプレートリーダーを使用して、この柔軟なアッセイを実行する方法を示します(図1)。SoftMax® Proソフトウェアには、プレートリーダーの結果を自動計算するための設定済みプロトコルが含まれています。
図1:EarlyTox Caspase-3/7 NucView 488アッセイのワークフロー。
材料
- EarlyToxカスパーゼ-3/7-D NucView 488アッセイキット
◦DMSO製剤
◦*
▫エクスプローラーキット(2プレートサイズ、Molecular Devices P/N R8348)
▫バルクキット(10プレートサイズ、Molecular Devices P/N R8349) - EarlyTox Caspase-3/7 NucView 488アッセイキット
◦PBS製剤
▫エクスプローラーキット(2プレートサイズ、Molecular Devices P/N R8350)
▫バルクキット(10プレートサイズ、Molecular Devices P/N R8351) - HeLa細胞(ATCC P/N CCL-2)
- スタウロスポリン(Sigma P/N S5921)
- 96ウェル黒色透明底マイクロプレート(Corning P/N 3904)
- SpectraMax i3x マルチモードマイクロプレートリーダー
- SpectraMax® MiniMax® 300イメージングサイトメーター
方法
HeLa細胞を96ウェル黒色透明底マイクロプレートに100μLの培地中で、1ウェルあたり15,000個プレーティングした。37℃、5%CO2インキュベーター内で一晩接着させ、増殖させた。その後、アポトーシスを誘導するために、5 µMから0.005 µMまでのスタウロスポリンの1:2希釈系列で20時間処理した。
NucView 488基質の10 µM 2X作業溶液を培地で調製した。100µLの作業用基材溶液を、100µLの細胞と培地を封じ込めたウェルに直接加え、最終濃度を5µMとした。セルを遮光し、室温で15~30分間インキュベートした。SpectraMax MiniMax 300イメージングサイトメーターで541 nmの緑色蛍光チャンネルを使用してイメージングを行うか、SpectraMax i3x マルチモードマイクロプレートリーダーで励起波長490 nm、蛍光波長535 nmで検出した。
マイクロプレートリーダーで検出する場合、キットに含まれるオプションのMasking Reagentを、細胞基材のインキュベーション終了後にセルに添加した。マスキング試薬はキットの推奨希釈率(Explorerキットの場合、通常1:4希釈)でセルに添加した。マスキング試薬の添加後、直ちにプレートリーダーでプレートの下方測定を行った。
結果
スタウロスポリンで処理したHeLa細胞はアポトーシス反応を示し、EarlyTox Caspase-3/7 NucView 488 Assayを用いて検出および定量することができた。蛍光標識したアポトーシス細胞を、SpectraMax i3x マルチモードマイクロプレートリーダーとSpectraMax MiniMax 300イメージングサイトメーターを用いて検出した。
SpectraMax® MiniMax® 300イメージングサイトメーターで撮像したアポトーシス細胞を同定し(図2)、SoftMax Proソフトウェアを用いて解析した。アポトーシス細胞数対スタウロスポリン濃度をグラフ化し、4パラメータカーブフィットを適用した結果、EC50値0.10μMの濃度応答曲線が得られた(図3)。
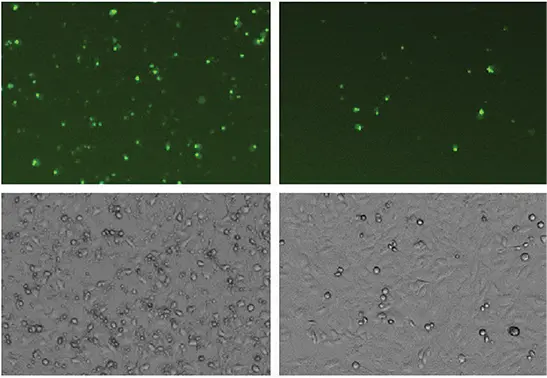
図2:HeLa細胞をスタウロスポリンで20時間処理し、アポトーシスを誘導した。NucView 488基質を最終濃度5 µMで添加した。SpectraMax MiniMax® 300イメージングサイトメーターの緑色(541 nm)蛍光チャンネル(上)と透過光チャンネル(下)を用いて細胞をイメージングした。
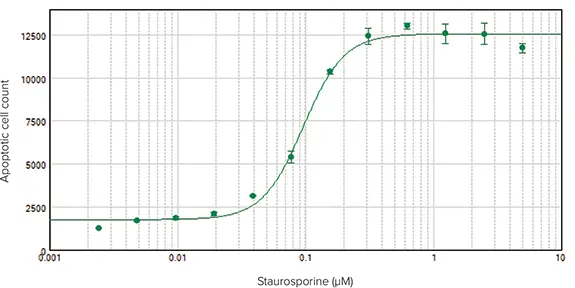
図3. SpectraMax® MiniMax® 300イメージングサイトメーターでイメージングしたスタウロスポリン処理HeLa細胞の濃度反応曲線。アポトーシス(緑色蛍光)細胞は、SoftMax Proソフトウェアを用いて画像中で同定し、カウントした。EC50 = 0.10 µM。
SpectraMax i3x マルチモードマイクロプレートリーダーで検出したアッセイでも、スタウロスポリンに対するHeLa細胞の濃度依存的応答が示された(図4、上)。プレートリーダーは、蛍光を背景にした個々のセルではなく、ウェルごとの総蛍光を検出するため、結果として得られる曲線はプラトーに達しない。しかし、プレートを読み取る直前にマスキング試薬をウェルに添加すると、バックグラウンド値が減少し、その結果、イメージングで得られたものと同様の、EC50値0.32 μMの完全な4パラメータ濃度応答曲線が得られた(図4、下方)。
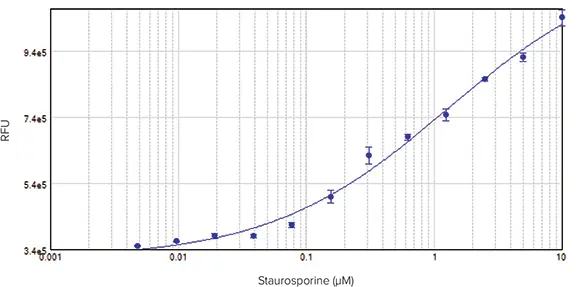
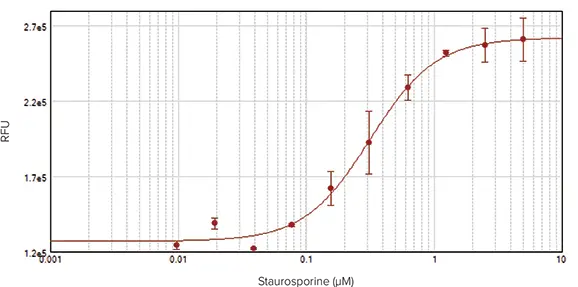
図4:HeLa細胞をスタウロスポリンで20時間処理してアポトーシスを誘導した。NucView 488基質(DMSO製剤)を最終濃度5μMで添加した。カスパーゼ活性に対応する蛍光を、SpectraMax i3x マルチモードマイクロプレートリーダーを用いて測定した。上:マスキング試薬なしのアッセイ。下: マスキング試薬をウェルに添加し、バックグラウンドを減少させたアッセイ(EC50 = 0.32 µM)。
結論
EarlyTox Caspase-3/7 NucView 488アッセイキットは、SpectraMaxマイクロプレートリーダーまたはSpectraMax MiniMax 300イメージングサイトメーターと併用することで、アポトーシスの定量に柔軟なアプローチを提供します。アポトーシス細胞は、ウェルあたりの総蛍光の関数として直接測定することも、個々の細胞をイメージングしてカウントすることもでき、どちらの方法でも同等の結果が得られます。オプションのMasking Reagentは、バックグラウンド蛍光を減少させ、EC50値をより正確に算出することができます。NucView 488 基質には2種類の製剤がある: DMSOとPBSである。PBS製剤は、DMSOに感受性のあるセルに使用できます。
EarlyTox細胞生存率アッセイキットについてさらに詳しく >>
PDF版(英語)