Application Note SpectraMax蛍光マイクロプレートリーダーでの
EarlyTox Caspase-3/7 R110アッセイキット
- 試薬添加1回のシンプルなワークフロー
- マイクロプレートフォーマットによるスループットの向上
- SoftMax Proソフトウェアで設定済みのプロトコル
PDF版(英語)
はじめに
アポトーシスは、高度に制御された細胞プログラムであり、胚発生などの正常過程だけでなく、癌や神経変性疾患などの疾患においても細胞死を引き起こす。アポトーシスのアッセイは、様々なイメージングやマイクロプレートリーダー検出システムを用いて実施することができ、正常および疾患に関連した細胞死のメカニズムに関する貴重な情報を提供する。
EarlyTox™ Caspase-3/7 R110 Assay Kitは、マイクロプレートリーダー用に特異的に設計されたシングルステップの均一性アッセイを提供する。蛍光基材(Ac-DEVD)2-R110は2つのDEVDコンセンサス標的配列を含み、細胞溶解液中で酵素により2つのステップで完全に加水分解される。両方のDEVDペプチドが加水分解されると、緑色の蛍光色素ローダミン110(R110)が放出され、励起は490 nm、エミッションは520 nmで、蛍光が大幅に増加する。図1に示すような簡略化されたワークフローは、1回のアッセイに必要なセル数を減らし、また複数のステップで通常遭遇するばらつきも減らす。
図 1:EarlyTox Caspase-3/7 R110 アッセイのワークフロー。
このアプリケーションノートでは、EarlyTox Caspase-3/7 R110アッセイキットとSpectraMax ®蛍光マイクロプレートリーダーの組み合わせについて報告します。R110色素からの蛍光シグナルは、SpectraMaxマイクロプレートリーダーを使用して検出でき、SoftMax® Proソフトウェアの設定済みプロトコルを使用して迅速に解析できます。
材料
- EarlyToxカスパーゼ-3/7 R110アッセイキット
◦Explorerキット(2プレートサイズ): モレキュラーデバイス P/N R8346
◦バルクキット(10プレートサイズ): Molecular Devices P/N R8347 - HeLa細胞(ATCC P/N CCL-2)
- スタウロスポリン(Sigma P/N S5921)
- 96ウェル黒色透明底マイクロプレート(Corning P/N 3904)
- SpectraMax蛍光マイクロプレートリーダー
方法
HeLa細胞を96ウェル黒色透明底マイクロプレートに100μLの培地中で、1ウェルあたり20,000個プレーティングした。37℃、5%CO2インキュベーター内で一晩接着させ、増殖させた。その後、5μMから0.04μMまでのスタウロスポリンの1:2希釈系列で4時間処理し、アポトーシスを誘導した。
基質アッセイバッファーは、細胞溶解/アッセイバッファーに酵素基材(AC-DEVD)2-R110(2mM)を1mLのバッファーに対して50μLの割合で加えて調製した。100μLの基質アッセイバッファーを各ウェルに加え、最終体積をウェルあたり200μL、最終基質濃度を50μMとした。その後、サンプルを室温で35分、1.5時間、または3時間インキュベートした。蛍光は、SpectraMax i3 マルチモードマイクロプレートリーダーを用い、表1に示す設定で測定した。R110 由来のカスパーゼ基質を用いた代表的な競合アッセイも比較のために行った(図2)。
| *下方からの読取式を推奨するが、この機能がない場合は、上方読取式でもよい。 | |
|---|---|
| パラメータ | 設定 |
| 読み取りモード | 蛍光 |
| 読み取りタイプ | 終点 |
| 波長 |
励起 = 490 nm 発光 = 520 nm |
| PMTと光学系 |
PMTゲイン: 自動 フラッシュ/リード:10 下方から測定を行う*。 |
表1. SpectraMax蛍光マイクロプレートリーダーの最適化されたインストゥルメンテーション。
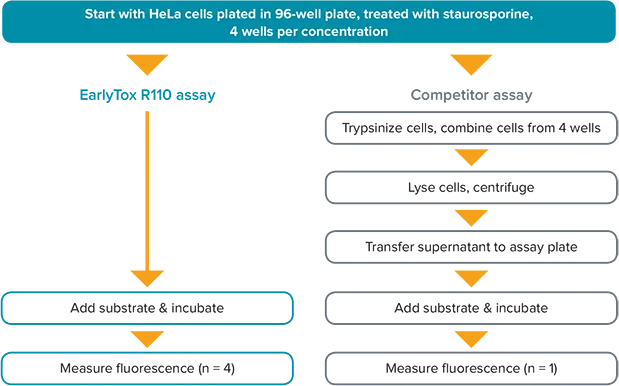
図2. EarlyTox Caspase-3/7 R110アッセイキットのワークフローと競合アッセイのワークフロー。
結果
スタウロスポリンで4時間処理したHeLa細胞はアポトーシス反応を示し、EarlyTox Caspase-3/7 R110 Assay Kitを用いて測定した。アポトーシス細胞に対応する蛍光は、SpectraMax i3 マルチモードマイクロプレートリーダーで検出した。結果はSoftMax Proソフトウェアで4パラメータカーブフィットを用いてグラフ化した。細胞基材中で35分、1.5時間、3時間インキュベートしたセルは、同様のEC50値を示した(図3)。
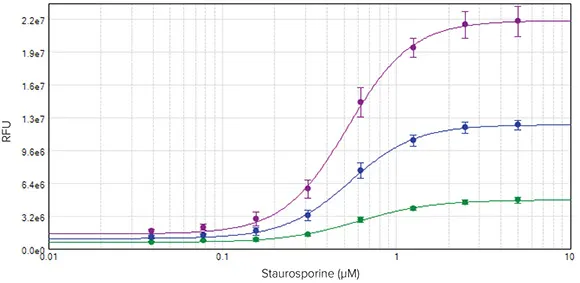
図3:スタウロスポリンで4時間処理したHeLa細胞の濃度反応曲線。細胞を基材中で35分(-)、1.5時間(-)または3時間(-)インキュベートした。アッセイプレートをSpectraMax i3 マルチモードマイクロプレートリーダーで読み取り、結果をSoftMax Proソフトウェアでグラフ化した。その結果、EC50値はそれぞれ0.61 μM、0.54 μM、0.52 μMであった。
代表的な競合キットと比較して、EarlyTox R110アッセイキットは結果を得るために必要な工程が少ない。アッセイ全体がマイクロプレートウェル内で直接行われるため、サンプルの移し替えやその他の面倒な操作は必要ありません(図2)。さらに、競合キットはアッセイサンプル当たりにより多くのセルを必要とする。ここでは、競合アッセイでは96ウェルプレートの4ウェルから細胞を組み合わせて各データポイントを取得しましたが、EarlyTox R110アッセイでは各ウェルから個別のデータポイントを取得することができました。これにより、複数の複製を実行し、標準偏差を計算することができます(図4)。
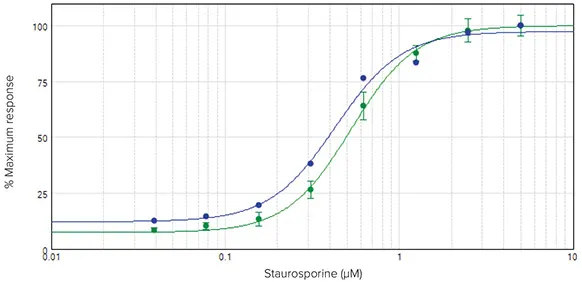
図4:EarlyTox Caspase-3/7 R110アッセイキットと競合キットのデータ比較。濃度反応曲線から算出したEC50値は、EarlyTox R110(-)が0.61 μM、競合キット(-)が0.54 μMであった。
結論
EarlyTox Caspase-3/7 R110 Assay Kitは、SpectraMax蛍光マイクロプレートリーダーと併用することで、マイクロプレートフォーマットのスループットを向上させながらアポトーシスを測定する簡便なワークフローをユーザーに提供します。競合キットとは対照的に、EarlyTox R110アッセイは、複数のウェルからサンプルをプールしたり、より大きなウェルプレートフォーマットでセルを調製したりする必要なく、96ウェルプレートのすべてのウェルから個別のデータポイントを得ることを可能にする。さらに、EarlyTox R110アッセイは、結果までの時間を短縮するために、追加のサンプル操作を必要とせず、1回の試薬添加ステップを提供します。
PDF版(英語)