Application Note SpectraMax蛍光マイクロプレートリーダーでの
EarlyTox生死判定キット
- シンプルなワークフロー-培地除去の有無に関わらずウェル内で直接測定
- マイクロプレートフォーマットによるスループットの向上
- SoftMax Proソフトウェアで設定済みのプロトコル
PDF版(英語)
はじめに
細胞生存率アッセイは、薬剤候補、パスウェイ活性化剤・ 阻害剤、レポーター遺伝子など、様々な治療の効果を評 価するためにしばしば行われる。細胞生存性をアッセイする最も一般的な方法の一つは、マイクロプレートリーダーでの蛍光検出である。ここでは、EarlyTox™ Live/Dead Assay KitとSpectraMax® 蛍光マイクロプレートリーダーを組み合わせて使用した結果を報告する(図1)。
EarlyTox Live/Dead Assay Kitには、哺乳動物細胞での使用に適した生細胞または死細胞のマーカーが2種類含まれています。カルセイン AM は広く使用されている生細胞マーカーです。非蛍光性のカルセインAMは無傷の細胞膜を透過し、細胞内のエステラーゼによって蛍光性のカルセインに変換されます。生細胞は細胞質内で強い緑色蛍光で染色される。細胞増殖アッセイや、生細胞染色のみを必要とするその他のアッセイでは、EarlyTox™ Live Cell Assay Kit(Explorer kitのP/N R8342、Bulk kitのP/N R8343)に含まれるように、カルセインAMを単独の試薬として使用することができます。
エチジウムホモダイマー-III(EthD-III)は実質的に無蛍光で、無傷の細胞膜に対して不透過性です。細胞死を伴う細胞膜の完全性が損なわれた場合、EthD-IIIは細胞内に入り、核酸に結合し、死細胞で明るい赤色の蛍光を発する。細胞膜の完全性に影響を及ぼす細胞毒性イベントは、この方法を用いて正確に評価できる。
カルセインおよびEthD-IIIからの蛍光シグナルは、SpectraMax蛍光マイクロプレートリーダーを用いて検出することができ、SoftMax® Proソフトウェアの設定済みプロトコルを用いて迅速に解析し、生細胞と死細胞の相対量を決定することができます。
図1: EarlyTox生死アッセイのワークフロー。
材料
- アーリートックス生死判定キット
◦Explorerキット(2プレートサイズ): モレキュラーデバイス P/N R8340
◦バルクキット(10プレートサイズ): Molecular Devices P/N R8341 - HeLa細胞(ATCC P/N CCL-2)
- スタウロスポリン(Sigma P/N S5921)
- 96ウェル黒色透明底マイクロプレート(Corning P/N 3904)
- SpectraMax蛍光マイクロプレートリーダー
方法
HeLa細胞を100μLの培地中、1ウェルあたり15,000個、黒色透明底マイクロプレートにプレーティングした。37℃、5%CO2インキュベーター内で一晩培養した。その後、アポトーシスを誘導するために、10μMから0.01μMまでのスタウロスポリンの1:2希釈液で24時間処理した。各濃度で4反復を行った。
カルセインAM/EthD-IIIの2X作業溶液は、カルセインAMとEthD-IIIのストック溶液をPBSに加え、各色素の濃度が6 µMになるように調製した。100μLの2X作業溶液を各アッセイウェルに加え、最終容量を200μLとし、各染料の最終濃度を3μMとした。プレートを室温で 50 分または 2.5 時間インキュベートした。その後、SpectraMax® i3 Multi-Mode Microplate Readerを用い、SoftMax Proソフトウェアであらかじめ設定したプロトコルを用いて、表1に示した設定でプレートを下から読み取った。注意:メデュームを除去した後、カルセインAMとEthD-IIIの1X溶液を添加することは任意であり、必要であればバックグラウンド蛍光を減少させるのに役立つ。
| パラメータ | 設定 |
|---|---|
| 読み取りモード | 蛍光 |
| 読み取りタイプ | 終点 |
| 波長 |
Lm1: Ex = 495 nm, Em = 530 nm Lm2 Ex = 530 nm, Em = 645 nm |
| PMTと光学系 |
PMTゲイン 自動 読み取り1回あたりのフラッシュ数:6 底面からの読み取り |
表1. SpectraMax i3 マルチモードマイクロプレートリーダーの設定。蛍光検出機能を持つ他の SpectraMax マイクロプレートリーダーでも同様の設定が可能です。ボトムリードを推奨しますが、この機能がない場合はトップリードを使用してもかまいません。
SoftMax Pro ソフトウェアの設定済みEarlyTox 生死アッセイプロトコールは、緑色/赤色比を自動的に計算し、化合物濃度などの実験条件に対してプロットすることができます。このプロトコールでは、実験細胞サンプル中の生細胞と死細胞の割合も計算できます。これらの計算を行うには、アッセイプレートに追加のコントロールをセットアップする必要があります1。
結果
スタウロスポリンで処理したHeLa細胞は明確な濃度応答を示し、これは生細胞(緑色蛍光)と死細胞(赤色蛍光)のシグナル比として容易に定量できた(図2)。全体として、RFU値は50分間インキュベートした細胞よりも2.5時間インキュベートした細胞の方が高かった。しかし、スタウロスポリン処理による緑色/赤色比の増加倍率は、どちらの時点でも同じであった。このように経時的な増加倍率が安定しているため、インキュベーション時間を柔軟に変更しても一貫した結果が得られる。どちらの場合も、EC50値はそれぞれ200 nMと207 nMで同等であった
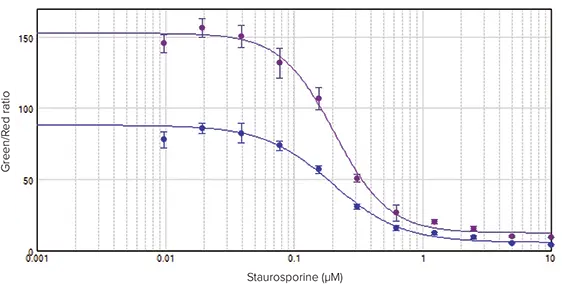
図2. スタウロスポリンで24時間処理したHeLa細胞の濃度応答曲線。細胞をカルセインAMおよびEthD-III中で50分間(-)または2.5時間(-)インキュベートした。濃度曲線は、赤(645 nm発光)RFUに対する緑(530 nm発光)RFUの比をY軸としてプロットした。SoftMax Proソフトウェアで4パラメータカーブフィットを適用した。EC50値は、50分インキュベーションで200 nM、2.5時間インキュベーションで207 nMであった。
結論
SpectraMaxマイクロプレートリーダーと併用することで、EarlyTox Live/Dead Assay Kitは、シンプルなワークフローとマイクロプレートフォーマットによるスループットの向上により、生細胞と死細胞の直接測定を可能にする。幅広いインキュベーション時間にわたって一貫した結果が得られ、ワークフローの柔軟性を提供します。SoftMax Proソフトウェアの設定済みプロトコールは、装置の設定を最適化し、自動データ解析により結果までの時間を短縮します。
参考文献
- EarlyTox 生死細胞アッセイキット製品概要
EarlyTox細胞生存率アッセイキットについてさらに詳しく >>
PDF版(英語)