Application Note SpectraMax MiniMaxサイトメーターを用いた
FluoroBlokインサートによる細胞遊走の評価
- 移動する細胞の高画質画像を非破壊で取得
- 細胞を直接カウントして正確なデータを取得
- SoftMax Proソフトウェアのポイント・アンド・クリック・ツールで細胞を素早く特定
PDF版(英語)
キャシー・オルセン博士、ホアン・ハー|アプリケーション・サイエンティスト|モレキュラー・デバイス
はじめに
細胞の移動は、広義にはある場所から別の場所への細胞の移動と定義され、胚発生や創傷治癒を含む様々なプロセスにおいて重要である。また、腫瘍細胞の浸潤、血管系への侵入、遠位部位のコロニー形成を含む転移(がん細胞が元の場所から体内の異なる部位に広がること)における重要なパラメーターでもある1。試験管内では、細胞は栄養素のような化学的シグナルに反応して移動する。がん細胞の移動メカニズムを理解することで、がん患者の転移を阻害する新規治療薬を開発することができる。
コーニングの特許取得済みFluoroBlok™インサートは、ポリエチレンテレフタレート(PET)メンブレンによって、細胞の懸濁液と化学誘引物質を含む下層の溶液を分離し、細胞の遊走または浸潤を測定することができます。PET膜は400~700nmの光の透過を遮断する。蛍光標識された細胞は、膜の8.0ミクロンの孔を通って移動し、化学誘引剤に到達する。これらの細胞は、ボトムリード型マイクロプレートリーダーやイメージングシステムで容易に検出される(図1)。移動した細胞はアッセイ中も生存しているため、エンドポイン トアッセイとタイムコースアッセイの両方が可能である。
FluoroBlokインサートを用いた細胞遊走の測定には、プレ ートの底から読み取った生の蛍光を用いることができるが、こ の方法には限界がある。RFU測定値を標準化するためには細胞の標準曲線が必要であり、蛍光細胞標識のばらつき、バックグラウンド蛍光、その他の条件がデータの質に悪影響を及ぼす可能性がある。細胞を直接カウントすることで、研究者は正確な細胞移動データを得ることができる。
ここでは、SpectraMax® i3x Multi-Mode Microplate ReaderとSpectraMax® MiniMax™ 300 Imaging Cytometerを使用して、FluoroBlokインサートを使用した細胞遊走の測定と、画像化された細胞の計数を実演します。
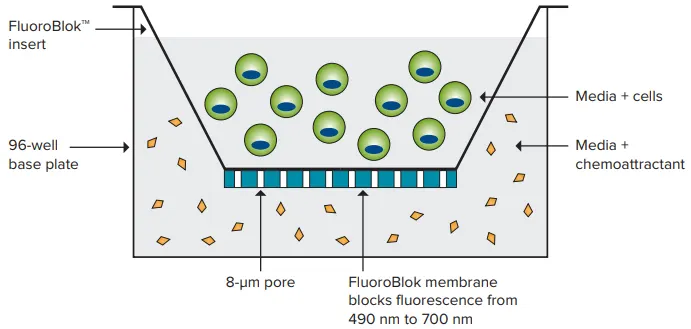
図1. FluoroBlokテクノロジー。蛍光標識された細胞はFluoroBlokインサート内に播種され、8µmの孔を通って移動し、底部から検出される。
材料
- FluoroBlok HTS 96ウェルマルチウェル透過性支持システム(8.0µm高密度PET膜付き)(コーニング社、商品番号351163
- SpectraMax i3x マルチモードマイクロプレートリーダー(Molecular Devices 社、商品番号 i3x)
- SpectraMax MiniMax 300 イメージングサイトメーター(Molecular Devices 社、商品番号 5024062)
- NIH3T3細胞 (ATCC cat. #CRL-1658)
- 最小必須培地(MEM, コーニング cat. #10-010)
- ウシ胎児血清 (FBS、Gemini Bio-Products cat. #100-106)
- 0.05% トリプシン EDTA (Corning cat. #25-051-CI)
- EarlyToxライブセルアッセイキット(Molecular Devices cat.R8342)
| パラメータ | セルカウントの設定 |
|---|---|
| 光学構成 | MiniMax |
| 読み取りモード | イメージング |
| 読み取りタイプ | エンドポイント 発光 = 520 nm |
| 波長設定 | 541 nm(緑色蛍光) |
| イメージング部位数 | 9 |
| 画像取得設定 | 541露光: 10 ms 541フォーカス調整:240 µm |
| 画像解析設定 | 解析タイプ 個別オブジェクト オブジェクトを見つけるための波長 541 |
表1. 撮影と解析の設定
方法
NIH3T3細胞は10%FBS添加MEM(完全MEM)で培養した。細胞をトリプシン処理し、無血清培地に再懸濁した後、EarlyTox™ Live Cell Assay Kitの4 µMカルセインAMで染色した。染色後、細胞を1ウェル当たり20k細胞ずつFluoroBlokインサートにピペッティングした。FBSを含む培地を細胞遊走のための化学誘引物質として用い、無血清培地を陰性対照として用いた。
FluoroBlok インサートの寸法に合わせて、SoftMax Pro ソフトウェアでカスタムプレート設定を作成した。SettingsのPlate TypeウィンドウからEdit Plateを選択し、Corningから提供されたプレート寸法に従って寸法を修正した。修正したプレート定義は新しい名前で保存した。このカスタムプレート設定は、今後のFluoroBlok実験に使用できる。
PET膜を移動するNIH3T3細胞の画像を取得するために、MiniMaxサイトメーターを使用した。画像は、Table 1に示す取得設定を用いて、20時間にわたっていくつかの時点で取得した。読み取り中の細胞の健康状態を最大にするため、リーダーの内部温度は37℃に設定した。
移動するNIH3T3細胞は、SoftMax Pro Softwareを用いて同定および定量した。画像解析設定で、解析タイプとしてDiscrete Object Analysisを選択した。蛍光強度とサイズに基づいて細胞を識別し、ソフトウェアにカスタム設定を作成した(図2)。代表的な細胞を4~6個クリックすることで、閾値が自動的に設定され、ソフトウェアによって細胞が識別された。移動する細胞数はソフトウェアを使ってグラフ化された。
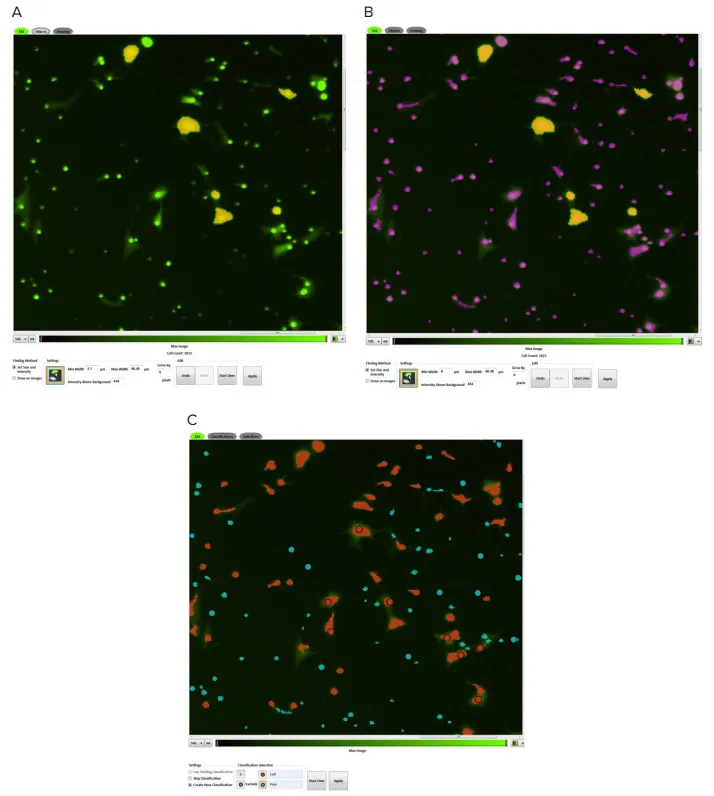
図2. オブジェクトの識別。NIH3T3 細胞は、SoftMax Pro ソフトウェアのアクイジション・エディターのポイント・アンド・クリック機能を使って同定した。図Aでは、ユーザーは既知の細胞(黄色でマーク)をクリックすることで、蛍光のサイズと強度を設定できる。ソフトウェアによって同定されたオブジェクトは紫色で表示される(B)。分類ツールを使用すると、細胞(赤色のマスク)と小さな孔(青色のマスク)を区別できる(C)。
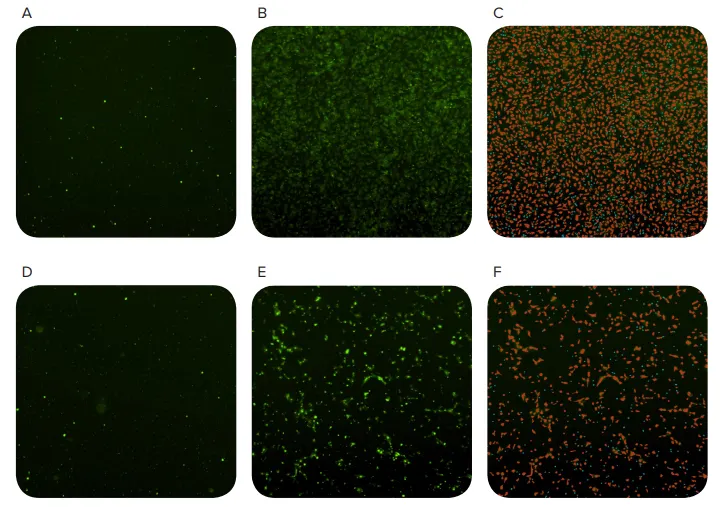
図3. MiniMaxサイトメーターを用いた細胞移動の追跡。細胞播種0時間後に取得した画像(AおよびD)、播種20時間後に取得した画像(BおよびE)、およびソフトウェアにより識別されたオブジェクト(CおよびF)。CとFの赤いマスクは細胞として分類された物体を示し、青いマスクはFluoroBlokメンブレンの孔として分類された小さな物体を示す。上段は化学誘引物質を含むウェル、下段は化学誘引物質を含まないウェル(陰性対照)。
結果
蛍光染色された細胞は、MiniMaxサイトメーターとSoftMax Proソフトウェ アを用い、FluoroBlokプレート内を移動しながら同定された(図3)。化学誘引剤を含まないウェルでもある程度の遊走は見られたが、20時間後、化学誘引剤存在下での細胞遊走は3倍近く増加した(図4)。
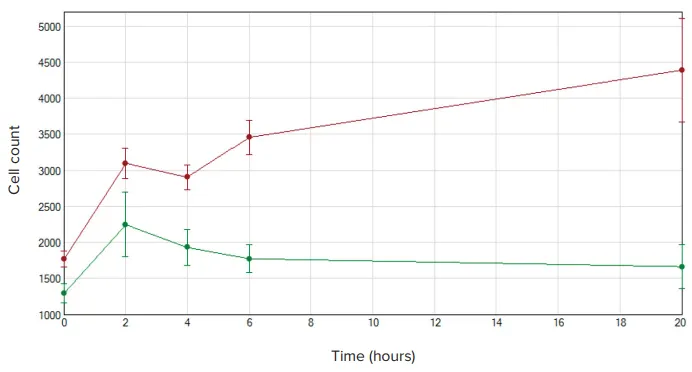
図4. 細胞遊走細胞数。NIH3T3 細胞数はSoftMax Proソフトウェアを用いてグラフ化した。化学誘引物質を含むウェルは赤で、陰性対照ウェルは緑で示す。最初はどちらの条件も最初の2時間で遊走を示したが、化学誘引剤を含むウェルの細胞数は時間の経過とともに増加し続けた。
結論
SpectraMax i3xリーダーおよびMiniMaxサイトメーターをFluoroBlok細胞培養インサートに使用することで、高画質画像から細胞を直接カウントし、経時的な細胞遊走を測定することができます。SoftMax Proソフトウェアは、シンプルなポイント&クリックのユーザーインターフェースにより、細胞数の解析を迅速に設定することができます。画像解析は、細胞染色レベルやバックグラウンド蛍光の影響を受ける生の蛍光と比較して、正確なデータを提供します。SoftMax Proソフトウェアの画像取得・解析機能と96ウェルFluoroBlokフォーマットを併用することで、研究者は豊富な細胞移動データを迅速に評価し、がんをはじめとする生物学の多くの分野における研究を推進することができます。
参考文献
- Chambers, Ann F., Alan C. Groom, and Ian C. MacDonald. 転移:転移部位における癌細胞の播種と増殖。Nature Reviews Cancer 2.8 (2002): 563.
PDF版(英語)