Application Note ライブセルアッセイを用いた細胞周期阻害剤の評価
- インストゥルメンテーション内で生きた細胞を最大72時間維持
- ハンズオンの時間を最小限に
- 明視野画像を用いた細胞のセグメンテーション
- 細胞周期センサーでトランスフェクトした細胞の分類
PDF版(英語)
はじめに
細胞周期に対する治療効果のモニタリングは、腫瘍学研究や創薬研究の進展に特に関連している。例えば、有糸分裂を阻害することが知られている化合物は、しばしばがん細胞の分裂を遅らせるために利用される。生細胞を用いたハイコンテントスクリーニングアッセイは、細胞周期期による細胞の分類を可能にするために開発された。この技術は、BacMamデリバリーシステムを用いて、細胞周期によって制御される2つの蛍光融合タンパク質を細胞に一過性にトランスフェクトする。
このタイムラプスアッセイは、環境制御を備えたImageXpress® Microハイスループットイメージングシステム内で2~3日間行われ、実験期間中ずっと生細胞が維持された。指定された時間間隔で、生細胞の明視野画像と蛍光画像の両方が収集された。完全なワークフローには、明視野画像に基づいてすべてのセルを同定し、次に細胞周期の異なるフェーズに存在する蛍光タンパク質の発現に基づいて各セルを分類する統合ソフトウェア解析モジュールによるタイムラプス画像の自動解析が含まれる。
細胞周期のフェーズを示す蛍光タンパク質の可視化
細胞周期は、試薬Premo™ FUCCI Cell Cycle Sensor(Thermo Fisher)を用いて経時的にモニターした。プレーティングの直前に、細胞を蛍光標識した細胞周期制御タンパク質、ジェミニンとCdt1でトランスフェクトした。ジェミニン-emerald GFPとCdt1-tagRFPは、それぞれFITCとTRITCに対応する波長で発光する。Cdt1とgemininは細胞周期の特異性フェーズにのみ存在するため、核におけるこれらの発現を用いて細胞を細胞周期フェーズで分類することができる(図1)。
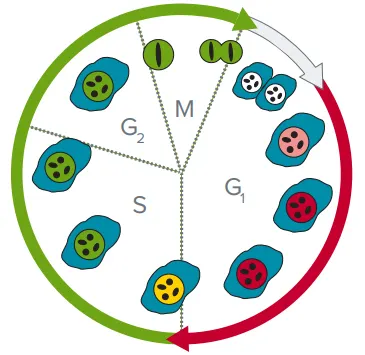
図1. FUCCI細胞周期センサーに関連した蛍光細胞変化。G1にあるセルはCdt1-RFP(赤)を発現する。G2/M期にあるセルはGeminin-GFP(緑)を発現する。S期にあるセルは黄色に見える(Geminin-GFPとCdt1-RFPの両方が発現)。
方法
- 細胞培養を調製するため、40,000細胞/mLのHeLa細胞懸濁液を各FUCCI試薬30粒子/細胞と予備混合し、96ウェルプレートに4,000細胞/ウェルの密度でプレーティングした。プレートを37℃、5 % CO 2で8時間プレーティングし、接着させた。
- 細胞を様々な濃度の細胞分裂阻害剤で処理した。その後、プレートをImageXpress Microシステムにセットした。
- ImageXpress Microシステムで、20x Plan Apo対物レンズを用い、2-3時間間隔で画像を取得した。各時間間隔で、明視野および蛍光波長チャンネル、FITCおよびTRITCで画像を取得するようにインストゥルメンテーションを設定した。画像取得は48-72時間後に停止し、セルが1-2回分裂を完了するのを待った。
- タイムラプス画像は、MetaXpress® ハイコンテント画像取得・解析ソフトウェアのカスタムモジュールエディター内で解析した。
イメージャーによる細胞の識別と蛍光細胞周期センサーによる細胞の分類
生細胞でFUCCI細胞周期センサーを使用することにより、化合物処理期間中の細胞周期の変化を測定することができ、固定エンドポイント分析よりも多くの情報を提供することができる。FUCCI細胞周期センサーをトランスフェクトしたHeLa細胞のタイムラプス画像を取得し、MetaXpress解析モジュールを用いて解析した。MetaXpress解析モジュールは、明視野画像中の細胞を識別し、核内の蛍光発現に基づいて各細胞を分類する。G1期の細胞は赤色蛍光を発し、G2/M期の細胞は緑色蛍光を発し、S期の細胞は赤色と緑色の両方の蛍光を発する(図2)。G0期のセルは蛍光シグナルを発しないが、明視野画像で検出され、全細胞数の解析に含まれる。さらに、必要であれば、各細胞周期期を経時的に追跡することもできる。
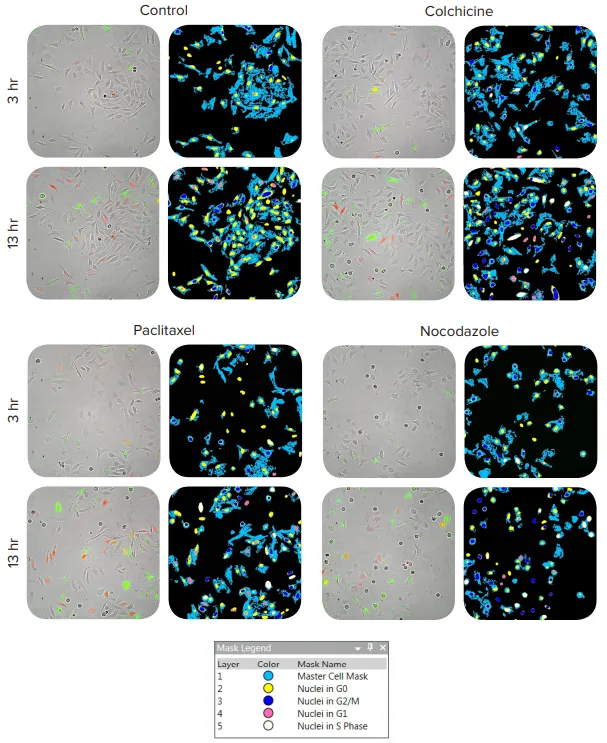
図2. FUCCI細胞周期センサーをトランスフェクトしたHeLa細胞のタイムラプス画像。この画像は、明視野画像中のセルを識別し、核内の蛍光細胞周期インジケーターの発現に基づいてそれらをスコア化するMetaXpress®ソフトウェアモジュールを用いて解析された: G1=赤のみ、G2/M=緑のみ、S=赤+緑、G0=非蛍光。2nMのパクリタキセル、10nMのノコダゾール、100nMのコルヒチンを投与した細胞について、時点2と6の代表的なオーバーレイ画像を示す。セグメンテーションマスクは、細胞周期の各フェーズでどのセルが同定されたかを示す。
細胞周期阻害剤は、細胞周期の特異的な相での細胞停止を引き起こす。
各時点の解析は、MetaXpress PowerCoreの並列処理機能を用いて高速化された。化合物処理24時間後、コントロールウェルの細胞の大部分はG0で静止し、細胞周期マーカーを発現する細胞はごく少数であった。パクリタキセルとノコダゾールで処理したセルは、G2/M期にかなりの数の細胞が存在し、時間経過の間、細胞停止状態を維持した(図3)。
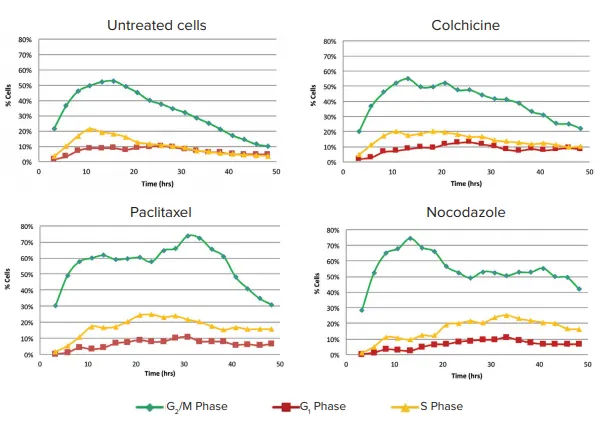
図3. パクリタキセル処理(2 nM)は、S、G2、M期にある細胞の割合がコントロールより有意に高いことを示した。10nMのセルヒチン処理では、G2およびMにある細胞の割合がコントロールより有意に高かった。100 nMのノコダゾールで処理すると、細胞分裂が有意に阻害され(実験期間中、細胞数の増加は見られなかった-データは示さず)、細胞の半分はG2/M期に停止したままであった。
まとめ
プレモ™フCCIセルサイクルセンサー試薬は、環境制御とMetaXpress®ソフトウェアを備えたImageXpress®マイクロシステムと併用することで、非常に効率的なワークフローで、生きた細胞の細胞周期位相を正確に測定することができる。このハイスループットなスクリーニング技術は、長時間にわたって細胞の完全性を維持しながら、細胞周期マーカーの迅速かつロバストな画像ベース定量を科学者に提供します。さらに、MetaXpress® ソフトウェアを使用することで、明視野画像を解析する機能が提供され、生細胞に対して毒性のある細胞染色を使用する必要がなくなります。一貫性のある統計学的関連性のある定量分析により、濃度の異なる複数の化合物の試験が可能になり、あらゆる細胞周期アッセイのパラメーターに適合させることができる。
PDF版(英語)