Application Note カルシウムオシレーションや収縮パターンを測定することで
心機能を探る
- 2Dおよび3D心筋細胞サンプルのCa 2 +オシレーションを記録
- 複雑なカイネティックパターンの解析
- 経時的な蛍光変動を測定
- マルチパラメトリックピークデータの作成
- 高密度マイクロプレートで心機能に対する化合物効果をスクリーニング
PDF版(英語)
はじめに
レキュラー・デバイス
オクサナ・シレンコ博士|上級研究員|モレキュラー・デバイス
薬剤が心臓系に与える影響を開発プロセスの早い段階で理解することは、上市される薬剤の安全性を向上させる上で極めて重要である。1,2さらに、環境化学物質への曝露は心血管系疾患の危険因子であるが、多くの環境薬剤が毒性学的影響について十分に試験されていないのが現状である3。
ヒトiPSC由来心筋細胞は、初代心筋細胞の表現型と機能性に類似しており、初代細胞を使用することで生じるばらつきを回避することができる。iPSC由来心筋細胞は、薬物や化合物によって変化させることができる同期的な自発収縮を示し、生物学的製剤モデルとして有用である。機械的収縮は透過光で記録することができるが、Ca2+感受性蛍光色素を用いて観察されるカルシウムオシレーションパターンの乱れを利用することで、心筋細胞の拍動数および拍動パターンへの影響を測定できることが示されている5,6。iPSC由来心筋細胞において、タイムラプスイメージングとImageXpress® Microハイコンテントイメージャーシステムを用いてカルシウムオシレーションを記録・解析する方法は、これまでに報告されている4-6。
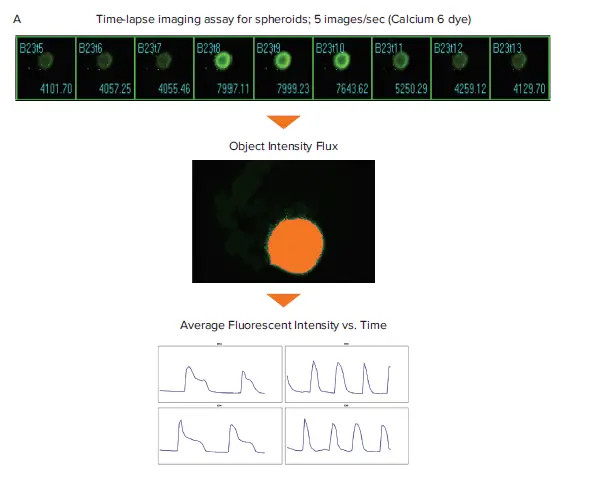
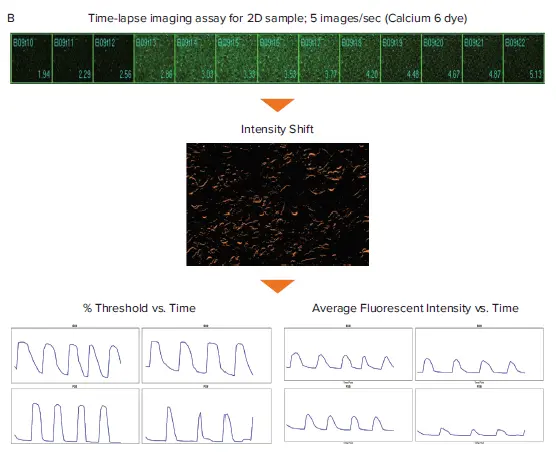
図1. スフェロイドおよび2D心筋細胞のCa2+オシレーショングラフの作成模式図。カルシウム6色素で染色したスフェロイドおよび2D iPSC由来心筋細胞のタイムラプス画像のフィルムストリップ。(A) 対物レンズ強度解析では、最大蛍光強度の画像からセグメンテーションマスクを作成する。このセグメンテーションは、与えられたスフェロイドの時点画像のスタック全体に適用され、蛍光強度の経時変化を測定する。(B) Intensity Shift解析は、経時的な蛍光信号の再分布を測定し、パーセンテージ閾値と平均蛍光強度測定値を生成する。
このテクニカルノートの焦点は、2Dおよび3D心筋細胞サンプルにおけるCa2+オシレーション信号トレースの可視化と解析のためのMetaXpress Peak Analysisツールの有用性を説明することである。iPSC由来の心筋細胞スフェロイドで実行した対物レンズ強度解析に焦点を当て、蛍光強度データの生成について説明する。さらに、拍動速度、ピーク幅、振幅、規則性を含むマルチパラメトリックピークリードアウトを作成する手順を要約する。
材料
- iCell心筋細胞2(富士フイルムセルラーダイナミクス株式会社)
- iCell心筋細胞プレーティング培地(富士フイルムセルラーダイナミクス株式会社)
- iCell心筋細胞維持培地(富士フイルムセルラーダイナミクス株式会社)
- 384ウェルマイクロプレート(コーニング、cat. #3712)
- 384ウェル、低付着性、U字型マイクロプレート(コーニング、cat. #3830)
- 0.1%ゼラチン(Sigma, St.)
- EarlyTox Cardiotoxicity KitまたはCalcium 6 dye(Molecular Devices社製)
- ImageXpress®マイクロコンフォーカルハイコンテントイメージングシステム、MetaXpress®画像取得・解析ソフトウェア、バージョン6.5(Molecular Devices社製)。
方法
ヒトiPSC由来心筋細胞は、製造業者のプロトコールに従って、2Dまたは3Dアッセイ形式で培養した。従来の2D培養では、384ウェルマイクロプレートに1ウェル当たり7,000個の細胞をゼラチンコートしたプレートにプレーティングした。3Dフォーマットでは、前述のように、5,000個の細胞をゼラチン存在下、低付着のU字型384ウェルマイクロプレートにプレーティングした。その後、心筋細胞をEarlyTox™心毒性キットまたはCalcium 6色素で染色した。Calcium 6色素は、心筋細胞収縮のカイネティック指標である細胞質カルシウムレベルの変化を測定するものである。この高速カイネティックイメージングは、ImageXpress® Micro Confocal システムを用い、対物レンズ 10 倍、FITC チャンネルを用いたワイドフィールドモードで行った。
MetaXpress の対物レンズ Intensity Flux と Intensity Shift ジャーナルを iPSC 由来の心筋細胞タイムラプス画像で実行し、平均蛍光強度またはパーセンテージ閾値データを作成した。ジャーナルはMetaXpress®ソフトウェアのマクロで、カスタム画像取得、画像処理、画像解析のワークフローを自動化するために使用できる。これらのジャーナルはワンクリックで実行でき、様々なタイプのセルやアッセイにおけるオシレーションの挙動を解析します。対物レンズ強度解析は、対物レンズを見つけて蛍光強度のオシレーションを解析します。図1Bは、心臓スフェロイド画像におけるこの解析を示しています。Intensity Shift解析は、画像の蛍光または明視野強度の経時的な再分布を測定します。適切な正規化オプションを選択した後、この解析は蛍光サンプルの記録と同様に透過光で撮影した心筋細胞の標識不要記録でも実行できます。図1Bは、2D心筋細胞画像のIntensity Shift解析を示す。蛍光強度と閾値のパーセンテージデータはグラフ化され、Ca2+オシレーション(心拍動を意味する)の下流のマルチパラメトリック計算に使用された(図2および3)6。
画像解析
細胞の蛍光強度の経時変化を測定
心筋細胞拍動の解析は、2Dおよび3D心筋細胞サンプルのシングルプレーン画像で行った。この例では、iPSC由来心筋細胞のスフェロイドをImageXpress® Micro Confocalシステムで0.2秒間隔で合計60ポイント撮像し、MetaXpressソフトウェアで対物強度Flux解析を行った。この解析は、時間点画像のスタックから最大強度のスフェロイド画像を特定し、その閾値をスフェロイドのセグメンテーションに使用する。この画像セグメンテーションを、あるウェルの時 点画像のスタック全体に適用し、平均蛍光強度を測定した(図1)
データ解析
ピーク解析トレースを用いた複数パラメーターの生成
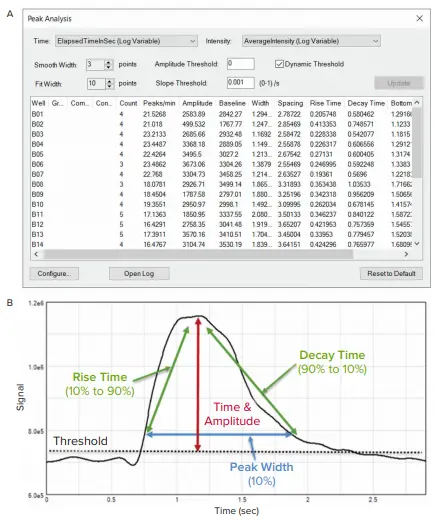
MetaXpress®ソフトウェアで平均蛍光強度対時間をプロットすることにより、化合物に対する細胞内Ca2+変動の表現型反応を容易に観察することができる。図2に示したオシレーション強度のグラフを用いて、ピーク解析の設定(図3A)を最適化し、トレースを最適に表現した。強度にウェル間のばらつきがある場合、動的閾値機能を選択することで、異なるウェルのピーク間の振幅と勾配の閾値のばらつきを調整します(図3A)。これにより、すべてのウェルでピークが正確に検出されます。Smooth Width値は、ピークデータの平滑化に使用するデータポイント数で、ピーク検出のノイズを平滑化するのに十分な高さでなければなりません。値が高すぎると実際のピークがカウントされなくなり、低すぎるとノイズスパイクをピークとしてカウントしてしまう可能性があります。ノイズのない完全なデータの場合は、平滑幅を1に設定することができます。
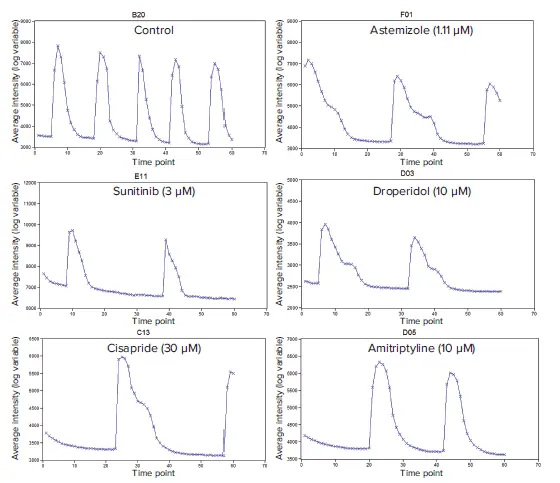
図2. 心毒性化合物の代表的なカルシウムフラックスシグナルのトレース(平均蛍光強度)。トレースは、影響を受けていない通常のCa2+フラックス(DMSOコントロール)パターン、影響を受けたアステミゾール、スニチニブ、ドロペリドール、シサプリド、アミトリプチリンパターンを含む典型的な表現型反応である。これらのトレースは、24時間処理した心筋細胞スフェロイドの反応である。
フィット幅は、ピークの幅を占めるデータポイントの数で、振幅や幅などのピーク測定値の計算に使用されます。
MetaXpressピーク分析ツールによって生成された測定値は、スプレッドシートまたはテキストファイルに簡単にエクスポートできます。測定値には、拍動数、ピーク振幅、ピーク幅、立ち上がりと減衰の時間、および規則性が含まれ、化合物治療に対する心拍動数とパターンの変化を詳細に見ることができる(図3B)。
結論
MetaXpress®ソフトウェアのバージョン6.5以上では、細胞収縮を代表するカルシウムオシレーションを含む複雑なカイネティックパターンの記録と解析が可能です。2Dおよび3D心筋細胞培養におけるCa2+振動の高速カイネティック蛍光イメージングをImageXpress Microシステムで行い、MetaXpress Peak Analysisツールで解析することで、高密度マイクロプレートでの化合物スクリーニングや心機能研究が可能になります。このオールインワンパッケージは、イメージング、解析、グラフやデータの生成をシームレスに組み合わせ、未処理および処理サンプルの心拍プロファイルの完全なビューを提供することで、薬剤候補の早期適格性評価や環境薬剤による心毒性効果の評価を可能にします。
参考文献
- Berridge BR, Hoffmann P, Turk JR, Sellke F, Gintant G, Hirkaler G, Dreher K, Schultze AE, Walker D, Edmunds N, Halpern W, Falls J, Sanders M, Pettit SD. Integrated and translational nonclinical in vivo cardiovascular risk assessment: ギャップと機会。Regul Toxicol Pharmacol. 2013;65:38-46. Web.
- ラバティ H、ベンソン C、カートライト E、クロス M、ガーランド C、ハモンド T、ホロウェイ C、マクマホン N、ミリガン J、パーク B、ピルモハメッド M、ポラード C、ラドフォード J、ルーメ N、セイガー P、シン S、スーター T、スーター W、トラフォード A、ヴォルダーズ P、ウォリス R、ウィーバー R、ヨーク M、ヴァレンティン J。Br J Pharmacol. 2011;163:675-693. Web.
- 環境化学物質の毒性データの現状。Environ Health Perspect. 2009;117:685-695. Web.
- Sirenko O, Crittenden C, Callamaras N, Hesley J, Chen YW, Funes C, Rusyn I, Anson B, Cromwell EF. ipsc細胞を用いた心筋細胞生理に対する化合物効果のin vitro多項目評価。J Biomol Screen. 2013a;18:39-53. Web.
- ヒト人工多能性幹細胞における拍動パラメータの評価により、心毒性の定量的in vitroスクリーニングが可能となった。Toxicol Appl Pharmacol. 2013b;273:500-507. Web.
- Sirenko O, Hancock MK, Crittenden C, Hammer M, Keating S, Carlson CB, Chandy G. "Phenotypic Assays for Characterizing Compound Effects on Induced Pluripotent Stem Cell-Derived Cardiac Spheroids". Assay Drug Dev Technol. 2017 Aug/Sep;15(6):280-296. Web.
PDF版(英語)