Application Note マウス胚性幹細胞とエンブリオイドボディの
蛍光・レーザー散乱イメージング
PDF版(英語)
はじめに

胚性幹(ES)細胞は、体内のあらゆる種類の細胞や組織を形成する可能性を持っており、胚発生や細胞分化の分子基盤を理解するための重要なツールである。ES細胞から分化を開始させる最も一般的な方法は、懸濁培養で胚様体(EB)と呼ばれる凝集体を形成させることである。この凝集体内のセル群は、様々な異なる組織に分化することが示されている。自己複製と分化のシグナルは精力的な研究の対象であり、特異的分化経路を活性化するプロトコルが開発されている。分化した細胞系譜を分離し、特徴づけ、精製する方法論を開発できるかどうかは、細胞を同定できるかどうかにかかっている。この報告では、レーザー散乱および蛍光イメージャー用のユニークな光学系を備えたImageXpress® Velosシステムが、この応用に適していることを実証する。
材料と方法
ImageXpress Velos System(Blueshift Biotechnologies, Inc.)で評価するために、マウスE14 ES細胞とEBをR. Pera博士の研究室(UCSF)から入手した。E14 ES細胞は、2mMグルタミン、1mMピルビン酸ナトリウム、1x非必須アミノ酸、10% FBS、1x BMEを添加したE14培地(グラスゴーMEM)で培養し、培地500mlあたり500μlのESGRO(LIF)を添加した。E14 ES株はゼラチンコートT-25フラスコで培養し、XX-ES株は照射マウス胚線維芽細胞(mEF)で培養した。PmaxGFP(E14-GFP)と名付けられたE14 ES株は、CMVプロモーターからGFPを発現した。XX-ES株は、マウスEBで発現するDazl-GFP系統特異性構築物を封じ込めた。E14コントロール、E14-GFP、およびXX-line(Dazl-GFP)を用いて形成されたEBを、6ウェルTCマルチウェルプレートを用いた懸濁液中でImageXpress Velos™を用いてスキャンした。
ImageXpress Velos. ImageXpress Velosシステムレーザースキャンプラットフォームは、以下のバンドパスフィルターを用いて3チャンネル取得用にセットアップされた: Ch1: 510-540nm(緑); Ch2: 450-490nm(レーザー散乱)、Ch3:560-610nm(オレンジ)。最初の画像取得は10×10ミクロンのサンプリング(ピクセル)サイズで行い、6ウェルプレート全体をスキャンした。スキャンエリアを定義した選択ウェルは、5 x 5ミクロンと2.5 x 2.5ミクロンの両方のサンプリングでスキャンした。画像はBlueImageソフトウェアを用いて対物レンズの同定と列挙を行った。
結果
Dazl-GFP ES株とネガティブコントロールESセルをmEFs上で増殖させ、スキャンした。ネガティブコントロールのES細胞は、散乱を用いた非常に良好なコロニー形態を示し、グリーンチャンネルでは非常に弱いシグナルであった。Dazl-GFP細胞は散乱画像で同様の形態を示し、緑色画像では強いシグナルを示した。特筆すべきことに、散乱画像は成長中のコロニーを検出するのに十分な解像度であった(図1)。
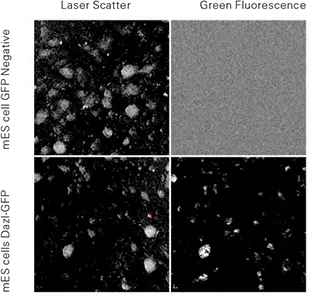
図1. マウス胚培養フィーダー(mEF)で培養したマウスES細胞。トップパネル: GFP陰性株のCh 2散乱(左)とCh 1緑色蛍光(右)。下パネル: Dazl-GFP発現株のCh 2散乱(左)とCh 1緑色蛍光(右)。画像は2.5ミクロンプレーティングで、細胞は6ウェルTCプレートに入れた。
E14-GFP ES細胞を分化培地に懸濁し、6ウェルプレートの各ウェルに2mlずつ加え、懸濁培養したEBを3日間分化させた後、ImageXpress Velosシステムでスキャンした。図2は、E14-GFP 3日目EBの5 x 5ミクロン散乱画像である。レーザー散乱画像は、EB中の光学的に暗い領域と、TCグレードの6ウェルプレートで得られた典型的な画質を示している。緑色発光と散乱像の比較は、ImageXpress Velosシステムのユニークな光学系がEB内の蛍光シグナルの検出を可能にすることを示している。これは、レーザービームの焦点に沿って蛍光シグナルが発生するためである。この結果は、この組み合わせが、目的の蛍光シグナルを持つ細胞を封じ込めたEBの同定に使用できることを示唆している。緑色のGFPとオレンジ色の画像を比較すると、GFPの発光はオレンジ色のチャンネルでも観察されることがわかる。

図2. 6ウェルTCプレートにおける胚様体のクラスタリング。
自家蛍光シグナルから GFP 発現を識別する能力を評価し、直接比較するために、Dazl-GFP 導入遺伝子を導入した 3 日目の EBs を封じ込めたウェルに陰性コントロール EBs(GFPなし)を加えた。GFP陰性対照EBはDazl-GFP EBよりも弱い緑色発光を示し、平均蛍光は陰性対照の約2.5倍の明るさであった。オレンジ発光チャンネルでは、Dazl-GFP EBsはネガティブコントロールEBsより約1.9倍明るかった。緑色の平均蛍光とオレンジ色の平均蛍光の散布図は、この比率がバックグラウンドの自家蛍光を持つEBとGFP発現EBを区別することを示した(図3)。自家蛍光シグナルから弱いGFP発現を識別する能力を評価するためには、さらなる研究が必要である。
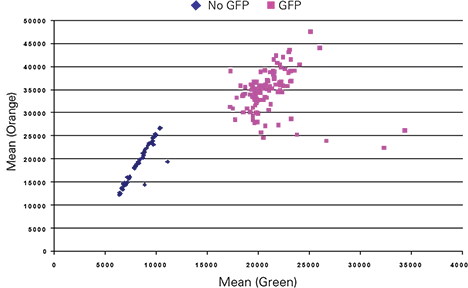
図3. 粒子分析によるCh 1緑色とCh 3オレンジ色の平均蛍光の散布図。緑色と橙色の比率は、GFPなしとDazl-GFP EBsを区別した。
8日間分化培養したE14-GFPとE14対照EBを1:1で混合した。画像は2.5ミクロンサンプリングで取得した。これらの画像を用いたBlueImage解析結果と散乱信号の閾値処理により、EBを対物レンズとして同定し、EB特異性蛍光パラメーターを生成しました。緑色対オレンジ色のEB分析を、最大蛍光値を用いてプロットしました(図4)。プロットを比較すると、蛍光の最大値によって、GFPを発現しているE14-GFP EBsとGFPを発現していないEBsが明確に区別されることが示された。データは定義された関心領域(ROI)を用いて作成され、合計64個のEBが同定され、対物レンズとして分類された。64個のEBのうち、28個は緑色蛍光の最大値が10,000相対蛍光単位(RFU)を超えていた。
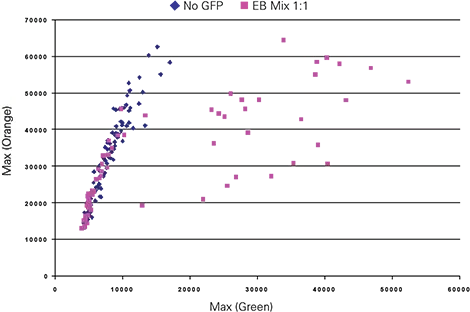
図4. 最大蛍光を用いたCh 1 green対Ch 3 orange粒子分析の散布図。緑色とオレンジ色の比率は、GFPなしとE14-GFP EBを区別した。
次に、E14-GFPとE14対照ESセルを1:1000の割合で混合してEBを形成し、8日間分化させた。EBを2.5ミクロンサンプリングでスキャンし、BlueImage解析プログラムを用いて散乱によりEBを同定し、EB内の蛍光対物レンズを列挙することを目的とした。緑色対オレンジ色の最大蛍光値がプロットされ、さらなる解析のために1つの対物レンズが同定された(図5上;緑枠内のデータ点)。x,yの位置パラメータを用いて、散乱画像と対応する緑色およびオレンジ色の画像から物体の位置を特定した(図5下)。
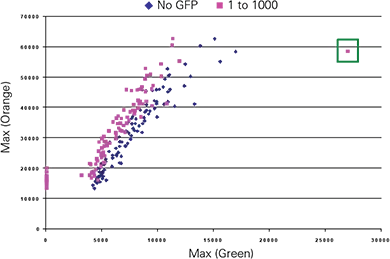
図5. E14-GFPとE14対照ESセルを1:1000の割合で混合して形成したEBにおけるGFP発現の検出。2.5ミクロンサンプリングの画像は、散布画像上で閾値処理し、緑色蛍光を測定することで処理した。上のグラフ:最大蛍光によるCh 1緑色対Ch 3オレンジ色のEB解析の散布図。データ点(緑枠)と分類パラメータによって特定された対物レンズ(下パネル)。下図は散布図と、緑色とオレンジ色の蛍光イメージで選択されたEB(選択ボックス)と対応する領域を示す。選択されたEBは直径約400ミクロン。緑色の蛍光領域は約800 µ2であった。
PDF版(英語)