Application Note iPSC由来肝細胞スフェロイドを用いたハイコンテンツ3D毒性アッセイ
- ヒトiPSC由来肝細胞を用いた肝スフェロイドの形成
- in vitroスクリーニングのための3Dモデルを用いた肝毒性評価
- 3D画像を解析し、対象物の適切な検出とセグメンテーションを決定する
PDF版(英語)
はじめに
発生生物学や組織生物学のトランスレーショナルリサーチを加速させる目的で、3次元(3D)スフェロイドをモデル化することへの関心が高まっている。本研究では、ヒトiPS細胞由来の3次元肝臓スフェロイドの形成法と、毒性評価のための共焦点イメージングおよび解析法を開発し、最適化した(図1)。
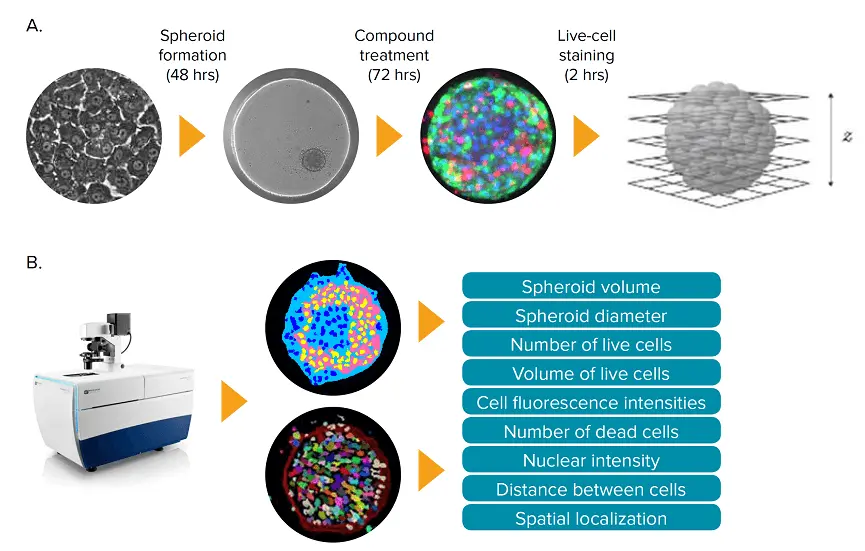
図1. iCell肝細胞由来の3Dスフェロイド肝微小組織を用いた肝毒性アッセイ。(A) iCell肝細胞を2Dフォーマットで7日間培養した後、3D培養を行った。スフェロイド形成後、肝微小組織を化合物で72時間処理し、2時間染色して画像化した。Z平面はImageXpress Micro Confocalシステムを用いて取得した。(B)取得したZプレーン画像を用いて、2Dおよび3D画像セグメンテーションのセットを作成し、3D培養の主要な表現型の特徴を定量化するために解析した。
肝臓スフェロイドの形成
ヒトiPSC由来肝細胞4、iCell Hepatocytes 2.0(Cellular Dynamics International)およびHepG2(ATCC)を用いた。凍結保存した細胞は、メーカーのプロトコールに従って解凍・維持した。ヒトiPSC由来肝細胞のスフェロイド培養を調製するため、iCell Hepatocytes 2.0を2次元培養であらかじめプレーティングした後、アキュターゼで剥離し、Geltrex溶液(ThermoFisher Scientific)と混合し、低付着性スフェロイドプレート(InSpheroまたはCorning)に1000細胞/ウェルでプレーティングした。次に、プレートを37℃、5% CO2の加湿インキュベーターに置く前に、細胞を沈降させ気泡を取り除くために300 x gで2分間遠心した。HepG2培養ではマトリックスの添加は必要なかった。スフェロイドは24~48時間以内に形成された。
無洗浄染色プロトコールによる肝毒性評価
肝毒性試験化合物で72時間インキュベートした後、スフェロイドを滅菌リン酸緩衝生理食塩水(PBS)で調製した3種類の色素の混合物で染色した:2μMのカルセインAM、3μMのEthD-1、および10μMのHoechst 33342(Life Technologies)。別の実験では、CellEvent Caspase 3/7試薬7.5μMとMitoTracker Orange 200 nM(Life Technologies)を用いて、化合物のアポトーシスシグナル伝達の引き金となる能力、あるいはミトコンドリアに影響を与える能力を評価した。
色素溶液をスフェロイド培養に添加し、イメージング前に2時間インキュベートした。色素溶液は洗い流さず、スフェロイドの損失、崩壊、変位を避けるため、ピペッティングの際には注意を払った。スフェロイドの代表的な合成画像を図2に示す。
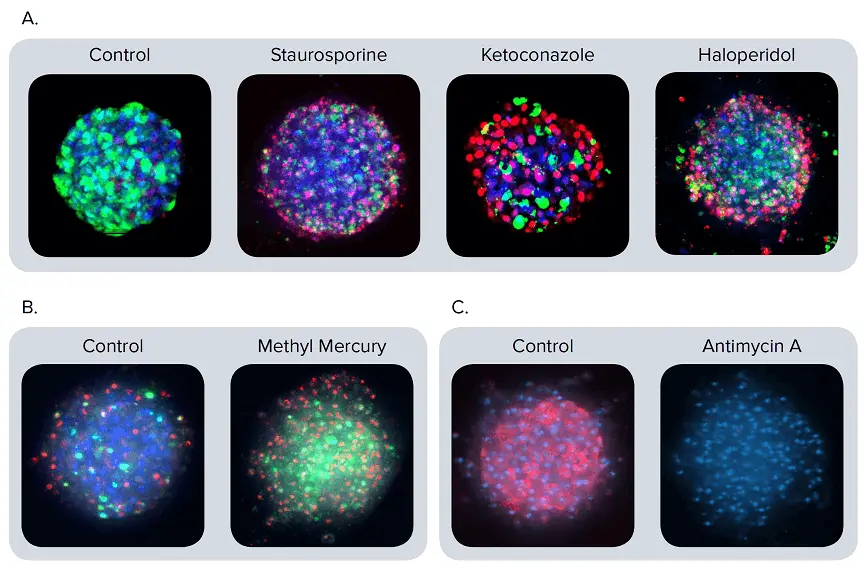
図2. 異なるマーカーで染色したスフェロイドの代表的な合成像。(A)スフェロイドをスタウロスポリン1μM、ケトコナゾール30μM、またはハロペリドール30μMで72時間処理した。カルセインAM(緑)、ヘキスト(青)、EthD-1(赤)で染色した後の合成画像。(B)アポトーシスは、CellEvent Caspase 3/7(緑)、EthD-1(赤)、Hoechst(青)で染色したスフェロイドの合成画像で明らかである。メチル水銀(1μM)で24時間処理したスフェロイドは、コントロールよりもはるかに多くのアポトーシス細胞(緑)を示した。(C)コントロールとアンチマイシンA(3μM)で処理したスフェロイドをMitoTracker Orange(赤)とHoechst(青)で染色した合成画像。アンチマイシンAはミトコンドリア膜の完全性を破壊する。そのため、ミトコンドリアの染色は見られない。
ハイスループット3D画像取得と解析の実施
ImageXpress® Micro Confocal High-Content Imaging System(Molecular Devices社製)を用い、10× Plan Fluorおよび20× Plan Fluor対物レンズで画像を取得した。100μmと120μmの距離、5-10μmで分離した11-17枚の画像のスタックを、ウェル底部から始めて共焦点イメージングを用いて取得した。2D最大投影画像を含む個々の画像はすべて保存し、解析時に使用した。
3Dオブジェクトの検出と解析
3D画像解析は、MetaXpress® High-Content Image Acquisition and Analysis Softwareを用いて行った。最新のCustom Module Editorには、マルチウェルワークフローにおける体積、蛍光強度、距離測定による3D構造の定量化を簡素化する新しいモジュール(図3)が搭載されている。Find Spherical Objects "オプションは、オブジェクトのおおよそのサイズ(幅の最小値と最大値、Z平面の最小値と最大数)、およびオブジェクトの強度対バックグラウンドのしきい値に関するユーザー定義の設定を使用して、オルガネラからマルチセルまでのおおよそ球状のオブジェクトを定義する。例えば、核は幅5~15μm、Zプレーン数1~2、閾値200相対蛍光単位で定義した。肝スフェロイドは、100-300μm幅、5-11Z平面、および400相対蛍光単位の閾値で定義された。スフェロイドの解析には、スフェロイドの体積、スフェロイドの直径、特定の蛍光チャネルにおけるスフェロイドの平均強度または積分強度が含まれる。
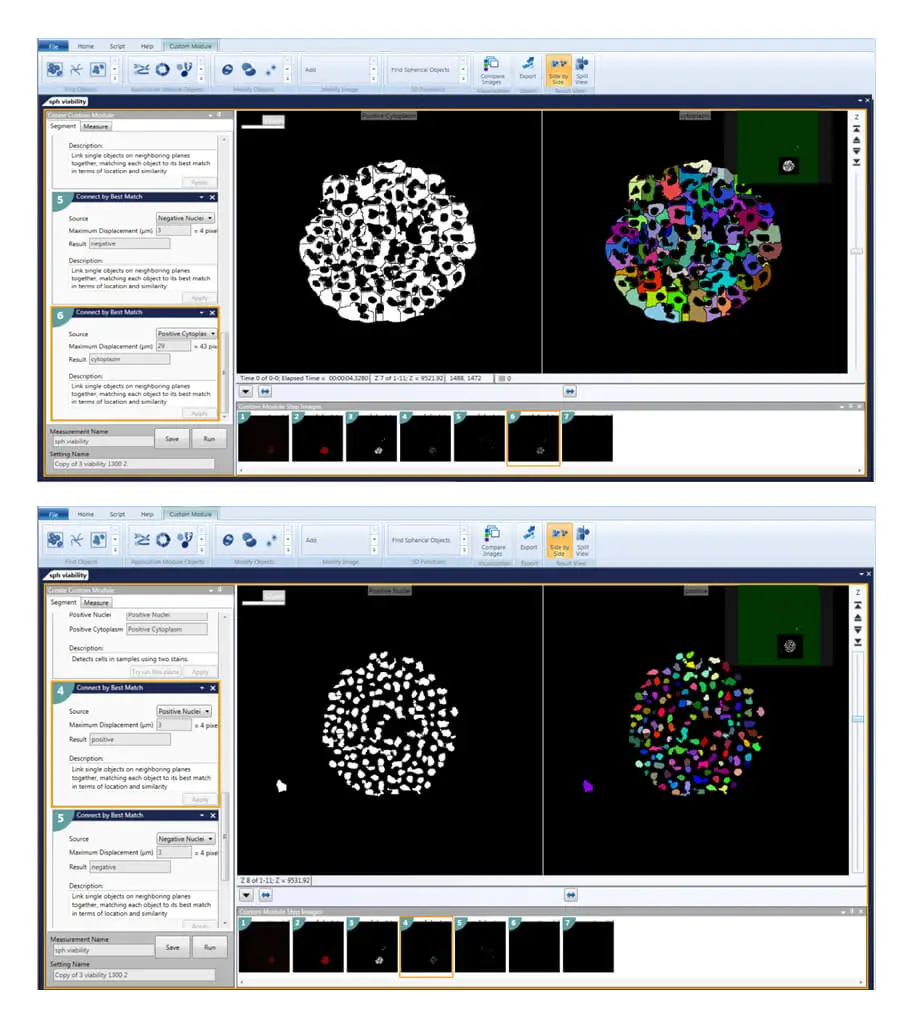
図3. カスタムモジュールエディターはスフェロイドの定義に使用できる。スフェロイドが定義されると、個々の細胞、核、細胞質などをカウントし、目的のマーカーに対して陽性か陰性かを解析することができる。
Find Spherical Objects解析は、個々の核や細胞、および個々の細胞の適切な特性を、個別のオブジェクトとして定義するためにも使用できます。3D構造解析モジュールの追加機能には、ユーザー定義のオプション「Best Matchで接続」、「Touchingで接続」、「オブジェクトを接続しない」に従って、異なる平面からオブジェクトを接続する機能が含まれます。
個々のZプレーンはまずセグメント化され、核数、生死解析、細胞スコアリングなどの測定のために、2D画像として解析される。次にオブジェクトは、ユーザー定義の各オブジェクトの最大変位、例えば核の最大変位は3~6μm、細胞質の最大変位は20~30μmで、"Best Matchで接続 "される。その結果、核や個々の細胞は、オブジェクトを欠落させたり、オブジェクトを二重にカウントしたりすることなく、3Dボリューム内でセグメント化され、スコア化される。これらのステップにより、カルセインAM陽性細胞や陰性細胞、エチジウムホモダイマー陽性細胞や陰性細胞など、すべての細胞を定義し、列挙することができます。
個々の細胞に異なる色を使用して、積分強度、平均強度、体積、直径、物体間の距離、3次元空間における物体の位置をセグメント化することができる。次に、スフェロイドマスクを用いて、マスクに含めるべき、あるいはマスクから除外すべき、より小さな物体を列挙することができる。例えば、1ウェルに1個のスフェロイドを含む肝細胞スフェロイドアッセイでは、単一細胞マスキングにより、すべての細胞を列挙することができ、スフェロイドに含まれる細胞やスフェロイドから除外される細胞を区別することができる。このステップは、スフェロイドの完全性が損なわれている場合に重要である。ウェルあたり数個または複数個のスフェロイドの場合(例えばマトリゲルアッセイ中のスフェロイド)、同様の分析を用いて各スフェロイドの細胞含量を定義し、平均化した測定値を報告することもできる。図4Aは、異なる2D平面におけるカルセインAM陽性細胞のセ ルスコアリング解析結果を示している。最後に、"Connect by Best Match "オプショ ンを使って3D空間でオブジェクトを連結する。同様のアプローチは、エチジウム・ホモダイマー陽性細胞 と陰性細胞の定義(生死解析)にも使用され、ミトコンドリア、強度、 アポトーシス、または他の所望の染色やマーカーの解析にも適用できる。
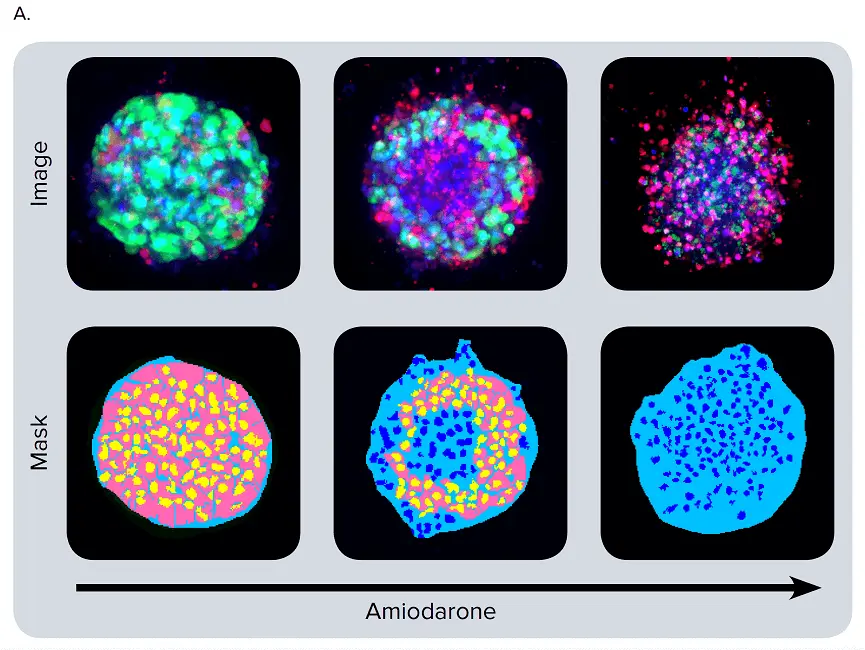
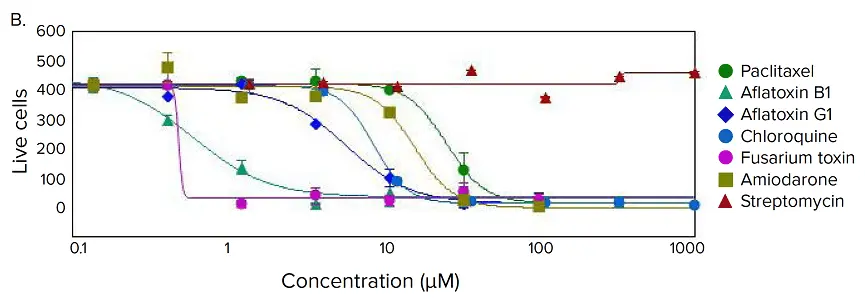
図4. 化合物処理後のスフェロイドの表現型変化。(A) iPSC由来肝細胞スフェロイドを肝毒性化合物(アミオダロン)の濃度を上げて処理し、生存率マーカーであるカルセインAM(緑)、ヘキスト(青)、EthD-1(赤)で染色したもの。画像解析マスクを合成画像の下に示す。(B)選択した化合物の用量反応曲線。
マルチパラメトリック表現型スクリーニングによる毒性評価
様々な肝毒素で処理した後、スフェロイドの表現型と細胞含量に有意な変化が観察された。多くのスフェロイドは球形を失い、崩壊、"ゆるみ"、"平坦化"、または "不規則 "に見え、細胞が本体から剥離し、あるいは細胞死により凝縮した核を示した。化合物処理後のスフェロイドにおけるこのような表現型の変化は、様々な濃度で生じた(図4B)。画像の定量的解析には、スフェロイドの形態学的特徴、細胞含量、複雑性を評価するパラメーターの導出が含まれた。体積、直径、蛍光強度を、カルセインAM陽性細胞数(生細胞)とEthD-1陽性細胞数(死細胞)とともに測定した。総細胞数は、化合物の効果に反応して減少することはなかった。その代わりに、化合物処理の結果、死細胞数の増加と、生細胞数の濃度依存的な減少が観察された。カルセインAMの平均蛍光強度は、スフェロイド全体および個々の分割された細胞(細胞質)において劇的に減少した。
細胞毒性メカニズムをさらに調べるため、アポトーシス表現型とミトコンドリアの完全性を評価した。カスパーゼ3/7色素を用いたアポトーシスの活性化は、化合物処理24時間後に測定した。対照細胞とメチル水銀で処理した細胞の典型的な活性化カスパーゼ3/7染色パターンを図2Bに示す。アポトーシスを引き起こす化合物で処理すると、カスパーゼ3/7染色強度とカスパーゼ3/7陽性(アポトーシス)細胞数が増加した。ミトコンドリア電位はMitoTracker Orange色素で評価した。ミトコンドリアの完全性に影響を与える化合物でスフェロイドを処理すると、MitoTracker Orange染色強度が用量依存的に減少した(図2C)。
生細胞数、カルセインAM蛍光強度、カルセインAM陽性細胞の体積などの測定結果は、有意なアッセイウインドウを示し、4パラメトリック用量反応曲線モデルにうまく当てはまった(図4B)。IC50 値(表 2)は、SoftMax® Pro 6 ソフトウェア(Molecular Devices)を用いて決定した。
| iCell 肝細胞 | ||
|---|---|---|
| 化合物 | IC50 3Dアッセイ (μM) | 説明 |
| メチル水銀 | 2.82 +/- 0.49 | 毒素 |
| フザリウム毒素 | 0.481 | 毒素 |
| アフラトキシンB1 | 0.595 +/- 0.145 | 毒素 |
| ドキソルビシン-塩酸塩 | 5.69 +/- 4.04 | DNAインターカレーター、抗がん剤 |
| スタウロスポリン | 0.91 +/- 0.12 | キナーゼ阻害剤、アポトーシス誘導剤 |
| マイトマイシンC | 2.28 +/- 0.246 | DNAインターカレーター、抗がん剤 |
| クロロキン | 18.60 +/- 0.247 | 抗マラリア剤 |
| ケトコナゾール | 20.4 +/- 10.7 | 抗真菌剤 |
| アミオダロン塩酸塩 | 22.6 +/- 9.68 | 抗不整脈、オートファジー誘導剤 |
| パクリタキセル | 26.2 +/- 6.39 | 微小管阻害剤 |
| フルオキセチン | 28.9 | 抗うつ薬 |
| ピモジド | 35.1 +/- 1.39 | 抗精神病薬 |
| ハロペリドール塩酸塩 | 52.2 +/- 21.6 | 抗精神病薬 |
表2. スフェロイドあたりの生細胞数を読み取り値として、選択した化合物について測定したIC50値。
まとめ
3D肝スフェロイドモデルとハイコンテンツ3Dアッセイを組み合わせることで、肝毒性を評価するための高感度かつ再現性の高いスクリーニングツールとして期待できる。動物データや臨床データと比較したアッセイの予測性はまだ確立されていないが、これらの方法とモデルをさらに発展させることで、in vitroスクリーニングにおける有用性が高まるであろう。
参考文献
- Chang, T. T., & Hughes-Fulford, M. (2009). ヒト肝細胞癌細胞株細胞の単層培養とスフェロイド培養は、異なるグローバル遺伝子発現パターンと機能的表現型を示す。Tissue Engineering Part A, 15(3), 559-567.
- Hartung, T. (2009). 21世紀のトキシコロジー。Nature, 460(7252), 208-212.
- Kunz-Schughart, L. A. (2004). ハイスループット・スクリーニングにおける3次元培養の利用: 多細胞スフェロイドモデル。Journal of Biomolecular Screening, 9(4), 273-285.
- Lu, J., Einhorn, S., Venkatarangan, L., Miller, M., Mann, D. A., Watkins, P. B., & Lecluyse, E. (2015). iPSCDerived Hepatocytes for In Vitro Toxicity Testing. Toxicological Sciences, 147(1), 39-54.
ImageXpress Micro コンフォーカルハイコンテンツイメージングシステムの詳細はこちら >>
PDF版(英語)