Application Note MetaXpress セルヘルスアプリケーションモジュールによる
アポトーシスの様々な段階のハイコンテント解析
PDF版(英語)
はじめに
Neal Gliksman, Ph.D., Mary David, Pierre Turpin, Ph.D., Paula Rickert, Ph.D., Molecular Devices Corporation, 1311 Orleans Dr., Sunnyvale, CA 94089 著

細胞の健康状態を研究することは、創薬や薬剤開発に欠かせないものとなっている。癌のようなある種の疾患では、突然変異がアポトーシス経路の機能不全を引き起こし、腫瘍性細胞の無秩序な増殖を許している可能性がある。対照的に、早すぎる細胞死は、パーキンソン病やアルツハイマー病を含む多くの神経疾患や、多くの免疫疾患や自己免疫疾患において問題となっている(1, 2, 3)。
細胞ベースアッセイは、薬剤の毒物学的効果をモデル化し、抗増殖作用とアポトーシスやネクローシスの誘導を識別するための効率的な方法を提供する。細胞死の機序を明らかにすることで、潜在的な薬物を修正し、意図しない毒性を防ぐことができる。細胞の健康状態の様々な段階を区別するために、様々な市販の蛍光プローブが開発されている。
Molecular Devices社のMetaXpress® ソフトウェアのセルヘルスアプリケーションモジュールは、3つの異なる色素を用いたアポトーシスとネクローシスの細胞ベースアッセイの解析用に設計されています。このソフトウェアモジュールは、複数の色素の組み合わせで操作できるように柔軟に設計されており、カスタマイズ可能な複数のセルごとの出力を得ることができます。シンプルなインターフェースはセットアップの手間を最小限にし、特異性に合わせて設定をカスタマイズする柔軟性を提供します。このモジュールには、Adaptive Background Correction™ (ABC)が含まれており、よりロバストなセグメンテーションとアッセイの再現性を提供し、局所的な含有量に適応して画像全体の不均一な背景を補正します。
この研究は、セルヘルスの指標として様々な核色素を用いた均一性アッセイであるVybrant® #7アッセイキットを用いて、MetaXpressセルヘルスモジュールの柔軟性と簡便性を説明しています。セルヘルスアプリケーションモジュールの詳細については、www.moleculardevices.com/pdfs/MX_CellHealth_Datasheet_Rev_B.pdf からデータシートをダウンロードしてください。ハイコンテントスクリーニングを用いたアポトーシス、ネクローシス、細胞死の定量」ポスターは www.moleculardevices.com/pdfs/SBSSBS04_LiveDead_CellHealth.pdf からダウンロードできます。
材料
- セル: DU 145 細胞(ATCC Cat.)
- セル培地: 10%dFCS入りHyQ/DME培地(Fisher Scientific Cat.)
- PBS(フィッシャーサイエンティフィック Cat.)
- スタウロスポリン(Sigma Cat.)
- DMSO(Sigma Cat.)
- Vybrant #7 Kit(Molecular Probes Cat.)
- プレーティング: 96ウェルブラック/クリアアッセイプレート、蓋付き、組織培養処理ポリスチレン、平底(Corning/Costar Cat.)
方法
細胞培養
- 接着細胞DU 145を、10% dFCS添加HyQ/DME培地で37℃、5% CO2で培養する。週1-2回、1:2-1:5の割合でセルを分割する。
セルヘルスアッセイ
- 各アッセイの前に、DU 145細胞を96ウェルプレートに1ウェル当たり7,000 細胞ずつプレーティングする。5%CO2中、37℃で一晩インキュベートする。
- 細胞培養液で希釈したスタウロスポリンまたはビヒクルコントロール(DMSO) を、様々な濃度(0.05~2μMの連続希釈)で細胞に添加する。37℃、5% CO2で16時間までインキュベートする。
- キットのプロトコールに従って、Vybrant #7プローブ(Hoechst 33342、YO-PRO-1、PI)をPBSで希釈する。
- 希釈したプローブを各ウェルに加え、30分間インキュベートする。
- MetaXpress® 画像取得ソフトウェアを使用して、ImageXpressMICRO™ システムで画像を取得します(Molecular Devices 社のイメージングプラットフォームはすべて Cell Health Application Module と互換性があります)。Vybrant #7 染料と互換性のあるフィルタを表 1 に示します。レーザーオートフォーカスが使用可能な場合は、画像取得速度を上げるために使用する。
表 1 に、撮影に使用した蛍光フィルターの組み合わせを示す。
| 表 1. Vybrant #7 蛍光色素のイメージングに使用したフィルターセット | |
|---|---|
| 蛍光プローブ | フィルターセット |
| ヘキスト33342 (H33342) |
ブライトライン® |
| YO-PRO-1 | BrightLine FITC-3540B (Semrock) |
| ヨウ化プロピジウム(PI) | Texas Red TXRED-4040B (Semrock) |
表1: 標準用量反応曲線を作成するために使用したcGMPキャリブレーターの用量。1アッセイ容量120 µL中の最終濃度。
自動画像解析
MetaXpressセルヘルスアプリケーションモジュールの詳細については、当社のウェブサイトwww. moleculardevices.com/pdfs/MX_CellHealth_ Datasheet_Rev_B.pdfから "Cell Health Application Module for MetaXpress "データシートをダウンロードしてください。
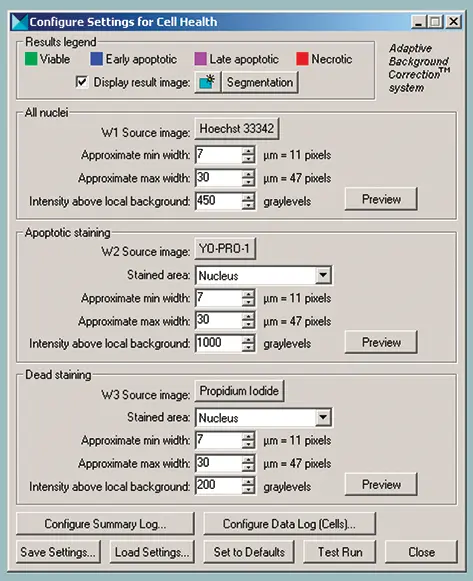
Cell Health Application Moduleダイアログで3つの波長を選択します。(図2参照)W1(Wavelength 1)は、すべての核を識別するために使用できる波長に対応します。W2は初期アポトーシスまたは後期アポトーシスにあるセル、W3は後期アポトーシスまたはネクローシスにあるセルの同定に使用される色素に対応します。W2およびW3については、細胞質、核、または両方のコンパートメントを染色する色素を選択し、より良い画像解析のためにこれらの位置をソフトウェアに示すことができる。Vybrant#7キットの場合、W1にはH33342、W2にはYO-PRO-1またはH33342、W3にはPIが使用される。各波長について、核染色陽性を同定するための適切なサイズ制約とコントラストレベルを選択する。
表 2 および表 3 に、本アプリケーションノートで使用した測定値を含め、セルヘルス・アプリケーションモジュールで測定可能なすべての部位ごとおよび細胞ごとのパラメータを示します。
| 表 2. MetaXpress セルヘルスアプリケーションモジュール† で利用可能な部位別測定値 | |
|---|---|
| 測定 | 内容 |
| Total Cells | 全核画像(W1)で検出された細胞の総数。 |
|
生存可能セル、 生存可能セル |
アポトーシスやネクローシスしていないセルの総数とパーセント。 |
|
初期アポトーシス細胞、 初期アポトーシス細胞, % Early Apoptotic Cells |
アポトーシス染色(W2)が陽性で、死染色(W3)が陽性でない細胞の総数と%。 |
|
後期アポトーシス細胞、 後期アポトーシス細胞 |
アポトーシス染色(W2)および死細胞染色(W3)陽性細胞の総数とパーセント。 Necrotic Cells, % Necrotic Cells アポトーシス染色(W2)では陰性だが、Dead染色(W3)では陽性の細胞の数とパーセントの合計。 |
|
全セル 総面積 全細胞 平均面積 |
全核画像(W1)で検出された細胞の総数。 |
|
All Cells W1 Integrated Intensity、 全セル W1 平均強度 |
核領域を用いてW1ソース画像で測定された合計および平均強度 |
|
全セル W2 統合強度、 全セル W2 平均強度 |
核領域を用いてW2線源像で測定された総強度と平均強度。 |
|
全セル W3 統合強度、 全セルW3平均強度 |
領域を使用してW3線源画像で測定された合計および平均強度。 |
注:このアッセイに使用された特異性測定値はカラーで示されている。
| 表 3. セルヘルスアプリケーションモジュールで利用可能なセルごとの測定値 | |
|---|---|
| 測定 | 内容 |
| セル:核面積 |
μm単位で測定された核面積 2 |
| セル:W1 統合強度、セル W1 平均強度 |
この核面積を使用して W1 ソース画像で測定された総強度と平均強度。 |
| Cell: Health Classification |
活性、初期アポトーシス、後期アポトーシス、 壊死のいずれかの核の分類。 |
| セル:W2 統合強度、セル W2 平均強度 |
この核領域を使用した W2 ソース画像で測定された総強度と平均強度。 |
| セル:W3 統合強度、セル W3 平均強度 |
この核領域を使用して、W3 ソース画像で測定された強度の合計と平均値。 |
結果
アポトーシス細胞検出のためのDNA染色
ハイコンテントスクリーニングでは、同一ウェル内で生細胞、壊死細胞、初期および後期アポトーシス細胞を区別し、細胞の亜集団を区別することができる。アポトーシス細胞死またはネクローシス細胞死を起こしている細胞の検出と定量に適した市販の蛍光プローブは多種多様である。これらのプローブは、選択性、モニターされる経路の分岐、シグナル対ノイズ比(S/N)、使いやすさにおいて様々である。
アポトーシスの間、核膜とクロマチンの両方が分解される。Vybrant #7アポトーシスアッセイキットは、DNAに特異的な3種類の蛍光プローブを用いてこの分解を検出する。
Hoechst 33342は細胞の健康状態に関係なく、すべての細胞に入る。アポトーシス初期に核が凝縮するため、DNA標識の平均強度はアポトーシス細胞で大幅に増加する。したがって、Hoechst 33342はすべての核のマーカーとしても、アポトーシス核のマーカーとしても使用できる。Hoechst 33342はUV光で励起され、青色に発光する4。
O-PRO-1はアポトーシス細胞に選択的に取り込まれる。YO-PRO-1は青色光で励起され、緑色に発光する5。
ヨウ化プロピジウム(PI)は膜不透過性で、一般に生存細胞からは排除される。後期のアポトーシスやネクローシスでは、膜の透過性が高まり、PIが細胞内に侵入してDNAを標識することができる。PIは緑色光で励起され、赤色に発光する6。
DU145細胞を増殖させ、DMSOまたはスタウロスポリンのいずれかで12時間処理し、方法に示した蛍光マーカーで標識した。ImageXpressMICROシステムを用い、自動多波長画像取得を行い、表1に示す蛍光フィルターを用いて、各部位について3枚の蛍光画像を取得した。
Vybrant#7キットで得られた蛍光画像(図1)
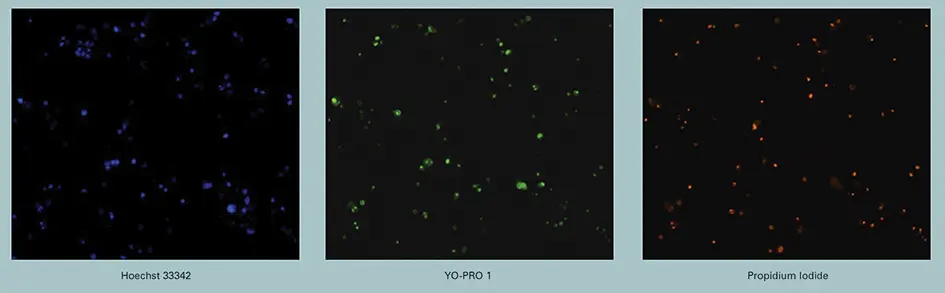
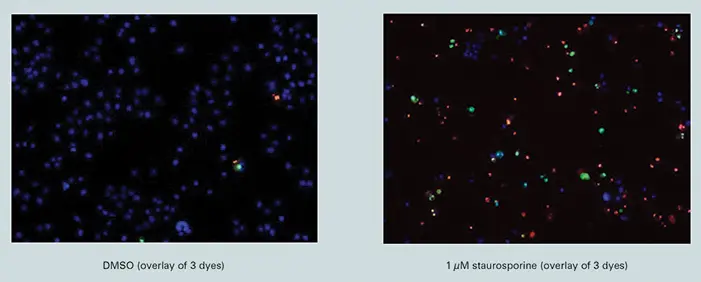
図 1 に示すように、最大濃度のスタウロスポリンの存在下では、3 種類の染料で非常に明瞭な染色パターンが得られた(図 1 の上部のシングルチャンネル画像、または下部の重ね合わせ画像)のに対し、未処理細胞では YO-PRO1 と PI 染色はほとんど認められなかった(下部の DMSO ビヒクル処理細胞の重ね合わせ画像)。これは、アポトーシス過程のさまざまな段階に対する染料の特異性と、染料からのシグナルを分離するイメージングシステムの能力を示している。
画像を自動的に解析するために、その柔軟性と使いやすさからセルヘルスアプリケーションモジュールが選ばれた(図2参照)。(図2参照)実際、アプリケーション・モジュールでは、使用する蛍光マーカーや標識する細胞コンパートメントを柔軟かつシンプルにカスタマイズすることができる。セルヘルス・アプリケーション・モジュールは、Adaptive Background Correctionを用いて、選択された各 Wavelengthにおいて陽性染色細胞を正しくセグメント化する。ユーザー設定可能な3つのパラメータが、各 Wavelengthおよびラベル付けされた特異性コンパートメントに使用されます。"近似最小幅 "と "近似最大幅 "は、各染色コンパートメントに予想されるサイズの範囲を指定します。"Intensity above local background "は、陽性に染色されたセルを最適に検出するために適宜調整される。部位ごとおよびセルごとの特異性測定値は、MDCStore データベース、Microsoft Excel、またはテキストファイルへのロギング用にユーザーが選択可能です。表 2 および表 3 に、セルヘルスアプリケーションモジュールで利用可能な測定結果を示します。MDCStoreデータベースに保存された解析結果は、AcuityXpressインフォマティクスソフトウェアでデータマイニングや可視化に使用することができます。
MetaXpress用セルヘルスアプリケーションモジュール(図2)
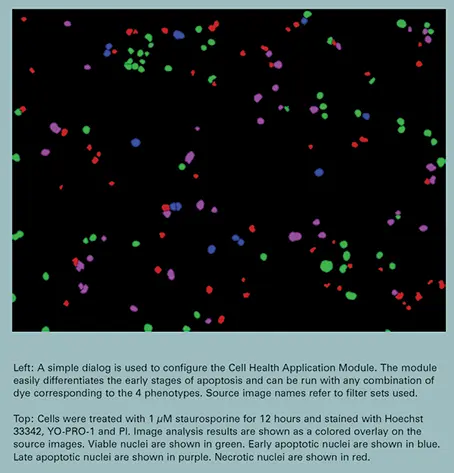
核凝縮はアポトーシスの初期段階の一つであり、このアッセイにより初期アポトーシスと超初期アポトーシスを区別することができる。核凝縮は、Hoechst 33342シグナルの強度の増加として見られる。YO-PRO-1の取り込みはアポトーシスの後期に起こるが、膜透過化の前である。明るく染色されたHoechst 33342とYO-PRO-1を用いた画像解析の比較では、凝縮した核を持つがYO-PRO-1では検出可能な染色を持たないセルが相当数確認された(図2参照)。
用量反応解析
AcuityXpressは、解析から得られた様々な用量反応のカーブフィット処理に使用された。セルヘルスアプリケーションモジュールは、Vybrant #7 キットを用いてロバスト性用量反応データを作成するために使用される。キナーゼ阻害剤スタウロスポリンの濃度を変えて12時間処理したところ、0.1~2μMの濃度で細胞生存能が劇的に低下した(図3参照)。(図3参照)また、細胞の表現型が濃度依存的に変化し、低濃度ではより多くの細胞が初期アポトーシスに陥り、0.3μM以上のスタウロスポリン濃度ではより多くの細胞が後期アポトーシスに陥ることが示された7。
結論
この実験は、Molecular Probes社のVybrant #7アポトーシスアッセイキットを用いて、細胞の健康に及ぼす影響について、多数の薬剤の迅速なスクリーニングに適用できるセルヘルスアプリケーションモジュールの使いやすさを示している。このモジュールは柔軟性に富んでいるため、細胞の健全性を示す他のさまざまな色素と互換性があります。また、潜在的な有毒・無毒の治療薬をスクリーニングしたり、有毒な薬剤を除外したり、毒性の特異性経路を分析するための強力なツールでもある。詳細は、ポスター "Quantitation of Apoptosis, Necrosis and Cell Death Using High Content Screening", www.moleculardevices.com/pdfs/SBSSBS04_ LiveDead_CellHealth.pdf を参照。
スタウロスポリン応答のAcuityXpress解析(図3)
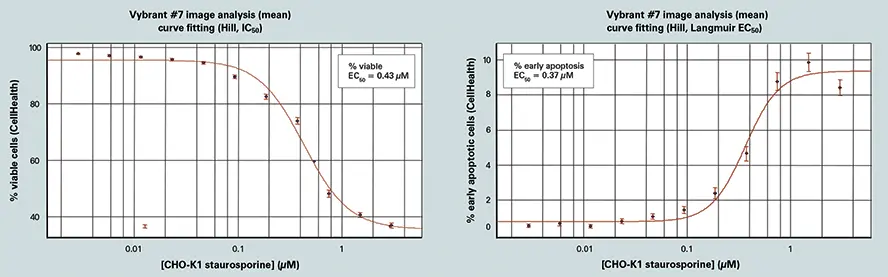
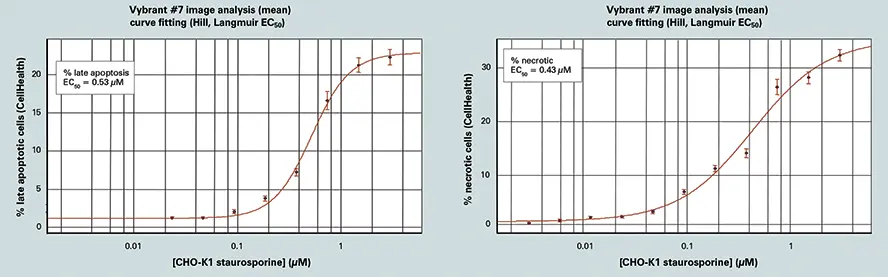
スタウロスポリンの増量に対するセルの反応(12時間処理)。画像解析と細胞分類はセルヘルスアプリケーションモジュールで実行。カーブフィット処理はAcuityXpressで行う。
参考文献
- J.M. Brown, L.D. Attardi (2005). 癌の発生と治療反応におけるアポトーシスの役割。Nat Rev Cancer 5(3):231-7
- D.W. Dickson (2004). アルツハイマー病神経原線維変性におけるアポトーシス機構:原因か結果か?J Clin Invest 114(1):121-30.
- W.G. Tatton, R. Chalmers-Redman, D. Brown, N. Tatton (2003). パーキンソン病におけるアポトーシス:神経細胞分解のシグナル。Ann Neurol 53(suppl 3): S61-70.
- L. Chiu, H. Cherwinski, J. Ransom, J.F. Dunne (1996). Hoechst 33342発光スペクトルのフローサイトメトリー比分析:アポトーシスリンパ球のマルチパラメトリックキャラクタリゼーション。J Immunol Methods 189(2):157-71.
- T. Idziorek, J. Estaquier, F. De Bels, J.C. Ameisen. (1995). YO-PRO-1は、細胞生存率を妨げることなく、プログラムされた細胞死(アポトーシス)の細胞蛍光分析を可能にする。J Immunol Methods 185(2):249-58.
- M. Vitale, L. Zamai, G. Mazzotti, A. Cataldi, E. Falcieri (1993). アポトーシスおよび壊死胸腺細胞におけるヨウ化プロピジウム取り込みのカイネティックの違い。Histochemistry 100(3):223-9.
- X. Wang, N.G. Zelenski, J. Yang, J. Sakai, M.S. Brown, J.L. Goldstein (1996). アポトーシスにおけるCpp32によるステロール制御エレメント結合タンパク質(SREBP)の切断。EMBO J 15(5); 1012-20.
PDF版(英語)