Application Note マイクロ流路プラットフォームにおける
3D神経細胞ネットワークの形態学的特性評価のための
ハイコンテントアッセイ
- iPSC由来ニューロンを用いたハイスループット3D神経突起伸長アッセイの確立
- microfludicなOrganoPlate®プラットフォームを用いて、よりin vivoに近い結果を得る。
- 神経細胞ネットワークに対する治療効果を評価するためのハイコンテントイメージャーの最適化
PDF版(英語)
はじめに
オクサナ・シレンコ|研究員|モレキュラー・デバイス
Karlijn Wilschut|シニアサイエンティスト|MIMETAS
生理学的に適切なin vitroモデルを確立することは、神経疾患のメカニズムのさらなる理解や標的薬剤の開発にとって極めて重要である。iPSC由来のニューロンは化合物スクリーニングや疾患モデリングに有望であるが、神経細胞ベースアッセイ開発のための有効なアプローチとして、三次元(3D)培養の利用が浮上している。3D培養は、構造、細胞組織、細胞-細胞間および細胞-マトリックス間の相互作用など、ヒト組織の側面をより忠実に再現していると認識されている1,2。
本研究の焦点は、マイクロ流路プラットフォームOrganoPlate®で開発したiPSC由来ニューロンを用いて、神経変性疾患や神経毒性スクリーニングのための3Dモデルを確立することを目的とした、ハイスループット3D神経突起伸長アッセイを開発することである3。OrganoPlate®は、3D細胞培養、Phaseguides™、マイクロ流体工学における最新の進歩を組み合わせたハイスループット・プラットフォームである4,5,6。OrganoPlateは、生細胞の長期培養に適した96個の組織チップを含み、スクリーニング目的に適合し、標準的なラボ装置やImageXpress® Microハイコンテントイメージングシステムのような自動化システムと互換性があります。
利点
- iPSC由来ニューロンを用いたハイスループット3D神経突起伸長アッセイの確立
- microfludic OrganoPlate ®プラットフォームを用いて、よりin vivoに近い結果を得ることができる。
- 神経細胞ネットワークに対する治療効果の評価のためのハイコンテントイメージングの最適化
材料
- OrganoPlate ® プラットフォーム(MIMETAS)
- ヒトiPSC由来iCell ®ニューロン(Cellular Dynamics International社製)
- ニューロン培地(セルラー・ダイナミクス・インターナショナル社製)
- マトリゲル(コーニング)
- カルセインAM(ライフテクノロジーズ)
- MitoTracker Orange(ライフテクノロジーズ)
- ヘキスト(ライフテクノロジーズ)
- サポニン(シグマ)
- PBS(シグマ)
- Αντι-β-チューブリンIII (TUJ-1) 抗体 (BD Biosciences)
- ImageXpress Micro ConfocalHigh-Content Imaging System(Molecular Devices社製)
- MetaXpressHigh-Content画像取得および解析ソフトウェア、バージョン6.2(Molecular Devices社製)
3Dマトリックスにおける神経突起ネットワークの形成
細胞培養、化合物処理、細胞染色工程は、マイクロ流体アッセイフォーマットを用いて行った。共焦点イメージングと解析プロトコルは、3Dマトリックスで培養したニューロンの形態学的表現型と生存率を評価するために最適化された。ヒトiPSC由来ニューロンを、OrganoPlate®内で最終濃度7mg/mlのマトリゲルとプレミックスした後、30,000セル/チップの密度でプレーティングした。プレーティング中、マトリゲル細胞懸濁液は氷上に保った。この溶液の播種量は、セル密度とマトリゲル濃度によりチップ当たり1~1.4 µLの間で変化した。播種後、プレートを組織培養インキュベーター(37℃、5% CO2)に30分間入れ、マトリゲルの重合を促進した。次に、50μLの成長培地をチップの培地注入口と排出口の両方に加え、組織培養インキュベーターに戻した。プレーティング後24時間で神経突起が形成され、最長14日間培養した。
神経毒性および神経細胞発達の試験におけるOrganoPlateプラットフォームの実行可能性を評価するために、これらの神経細胞培養を、神経突起伸長を阻害することが知られている化合物の選択で処理した7。化合物による処理はプレーティングの24時間後に行った。培養物は5日間処理にさらされ、その間、化合物を封じ込めた培地は2日おきに交換された。化合物の希釈は、OrganoPlateチップの培地入口と出口に添加する前に、適切な最終希釈液を培地に加えることで行った。
神経突起ネットワークの形成は、透過光イメージングを用いて経時的にモニターした。神経細胞の生存率を評価するため、生存率色素Calcein AM(1 µM)、ミトコンドリア電位色素MitoTracker Orange(1 µM)、Hoechst核色素(2 µM)の3つの色素の混合物を用いて細胞を生きたまま染色した。色素混合物をチップに加え、60分間インキュベートした後、培養液で置換した。あるいは、セルを4%ホルムアルデヒドで固定し、PBS中の0.01%サポニン溶液で透過処理し、β-チューブリンIII(TUJ-1)ニューロンマーカーに対する蛍光色素結合抗体(1:100希釈)を用いて染色した。核はHoechstで染色した。一次抗体による固定細胞の染色は4℃で一晩行った。
3次元培養の表現型解析
神経細胞ネットワークに対する治療効果を評価するために、ハイコンテントイメージングと解析を利用した。この3Dマトリックスにおけるニューロンの形態と生存率を評価するために、共焦点イメージングと解析プロトコルを最適化した。画像はImageXpress MicroConfocalシステムを用い、10倍、20倍、40倍の対物レンズで取得した。焦点軸に沿った異なる平面で一連の画像を取得した(Z-スタック)(図1)。深さ約150~300µmをカバーする、3~10µm離れた17~30面のスタックが取得された。個々の画像はすべて保存され、3D解析に使用されたほか、2Dプロジェクション画像(Maximum ProjectionまたはBest Focus)にも使用された。

図1. OrganoPlate中のニューロン*。
マトリゲル中のOrganoPlateキャピラリーウェルにプレーティングしたiCellニューロンの透過光画像。細胞はチップあたり30,000個の密度で72時間プレーティングした後、Plan Fluor対物レンズ20倍で透過光を用いてイメージングした。
最大プロジェクション画像の2D画像解析
画像解析にはMetaXpress®ハイコンテント画像取得・解析ソフトウェアを用いた。これらの画像の自動定量解析は、プロジェクション画像(2D)の解析とZ-スタック画像の3D画像解析の2つの方法で行われた。投影画像解析では、Z-スタック画像取得時に2D最大投影画像に変換し、MetaXpress Neurite Outgrowthアプリケーションモジュールを用いて解析した。表現型の読み出しには、神経突起伸長、突起数と分岐数、細胞数と生存率を含むいくつかのエンドポイント測定による、神経ネットワークの範囲と複雑さの定量的な特徴付けが含まれた。透過光画像の解析には、最良焦点プロジェクション画像を使用した。プロジェクション画像の解析は迅速であり、同時に神経ネットワークの範囲を正確に推定することができる。しかし、2D解析には限界がある。この方法では体積測定は計算されず、対物レンズの一部しかカウントされないのが普通だからである。図2および図3は、神経突起伸長測定に使用した「解析マスク」と、コントロールおよびロテノン処理した神経細胞培養の合成蛍光画像である。得られた測定値には、神経突起伸長、分岐数、突起数、および全セル数(細胞体)が含まれる。図4は、トリフェニルホスフェート、テトラエチルチウラム、ヘキサクロロフェン、ロテノン、メチル水銀(各10 µM)を含む神経毒性化合物への曝露による神経突起伸長長、分岐数、細胞生存能の減少を示している。
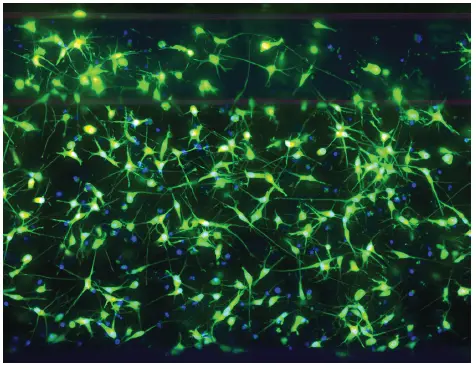
iCellニューロンを、マトリゲル中のOrganoPlateキャピラリーウェルに、1チップあたり30,000細胞ずつプレーティングした。細胞を5日間維持した後、生存率色素Calcein AM、ミトコンドリア完全性色素MitoTracker Orange、およびHoechst核色素で生きた細胞を染色した。その後、ImageXpress Micro Confocalsystemを用い、60µmピンホールスピニングディスク構成、DAPI、FITC、TRITCチャンネル、20倍率、6µm間隔で25枚の画像を共焦点モードで、3色のZ-スタック画像を取得した。最大プロジェクション合成画像をDAPIおよびFITCチャンネルについて示す。
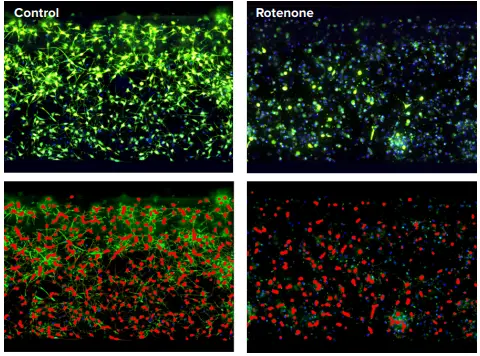
図3.神経ネットワークの2次元解析。
iCellニューロンをチップあたり30,000細胞の密度で24時間プレーティングした後、化合物で5日間処理し、生細胞をカルセインAM、ミトトラッカーオレンジ、ヘキストで染色した。3色のZ-stack画像を、ImageXpress Micro Confocalを用い、コンフォーカルモードで、60µmピンホールスピニングディスク構成を用い、20倍の倍率で取得した。最大プロジェクション画像はMetaXpress Neurite Outgrowthアプリケーションモジュールを用いて解析した。細胞体と神経突起のマスクを赤色で示す。コントロール(DMSO)とロテノン(10 mM)処理細胞のイメージングを示す。化合物処理の結果、神経細胞結合の崩壊が検出された。
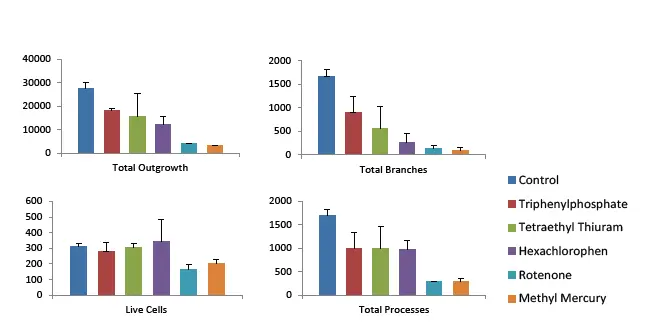
iCell Neuronsを図2のように培養し、指定した神経毒性化合物で5日間処理した。ImageXpressマイクロコンフォーカルシステムを用い、コンフォーカルモードで60回転ディスク構成20倍率で3色のZ-スタック画像を取得した。最大プロジェクション画像(3D画像スタックからの2D圧縮)は、神経突起伸長アプリケーションモジュールを用いて解析した。化合物(10 µM)の定量的効果は、アウトグロースの総数、生細胞の数、枝と突起の数で示されている。
3D可視化と3D画像解析
MetaXpressソフトウェアには、細胞やネットワークの3D可視化と同様に、隣接するZ平面からの対物レンズの結合を可能にする3D解析オプションがある。画像は、神経突起伸長を定量化するための "fibers "測定値を生成する "find fibers "機能を使用した3D解析カスタムモジュールを使用して解析した。
対物レンズはまず各平面で検出され、次に "connect by best match "機能を使って3D空間で連結される。3D解析は一般的に処理負荷が高いが、3D空間内の対物レンズ(重なり合う複数の対物レンズを含む)の分解能と定量性が向上する。3D解析から出力された測定値には、神経突起(線維)の数、セルの体積、線維の総体積、突起の数、分岐点などが含まれる。細胞(核)の総数は、Hoechst染色で陽性の「球状の対物レンズ」を見つけることで定義した。図5Aは、「線維」と「核」の解析マスクである。
細胞生存率(Calcein AM陽性の細胞体)とミトコンドリア完全性(MitoTracker Orange陽性の細胞体)の特性評価には、別のカスタムモジュールを使用した。3Dでのセルスコア解析は、生細胞(Calcein AM陽性)とインタクトなミトコンドリアを持つ細胞(MitoTracker陽性細胞)のカウントと特性評価に適用された。この解析法で算出された結果には、細胞数(全核)、生細胞数(カルセインAM陽性)、ミトトラッカー陽性細胞数、細胞体積または蛍光強度が含まれる。図5Bおよび5Cは、「カルセインAM陽性細胞質」、「ミトトラッカー陽性細胞質」および「核」の解析マスクを示す。図6は、神経突起ネットワークに対する化合物の影響を特徴付けるいくつかの測定結果を示している:突起(「ファイバー」)および分岐点の数の減少、ならびに生きた細胞または無傷のミトコンドリアを持つ細胞の数。
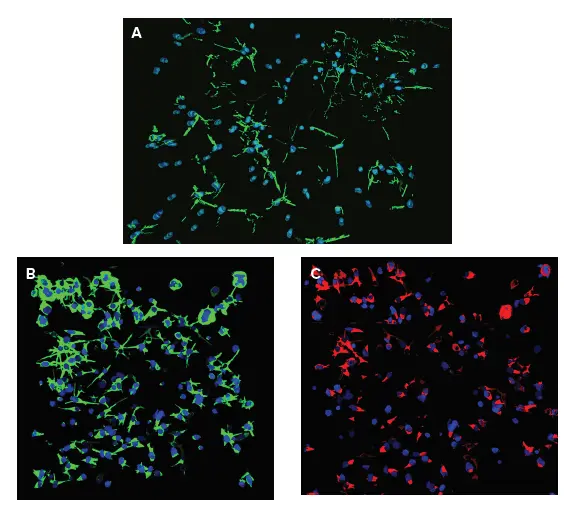
図5. 神経突起ネットワークの3D解析。**セルは図2に記載したように処理し、染色した。画像のZ-スタックをMetaXpressカスタムモジュールエディター3D解析オプションを使用して解析した。3Dにおける神経ネットワークの複雑さを評価するために、2つの異なる解析モジュールを使用した:ファイバー(神経突起)の測定とポジティブセルスコアリング(マーカー発現)。**(A)**カスタムモジュールエディター(CME)の "find fibers "および "connect by best match "オプションを使用して、神経突起(fiber)の数と体積、セグメントと分岐点を3D空間で検出し、カウントした。線維(緑)と核(青)の可視化を示す。**(B)**CMEの "Cell Scoring "および "Connect by best match "機能を用いて、全細胞数、カルセインAM陽性 "live "細胞数、およびカルセインAM陽性細胞質の体積を3D空間で測定した。核は青色、カルセインAM陽性細胞質は緑色で表示。**(C)*
MitoTracker Orange陽性細胞の数およびMitoTracker陽性細胞質の体積は、CMEの "Cell Scoring "および "connect by best match "オプションを使用して測定した。
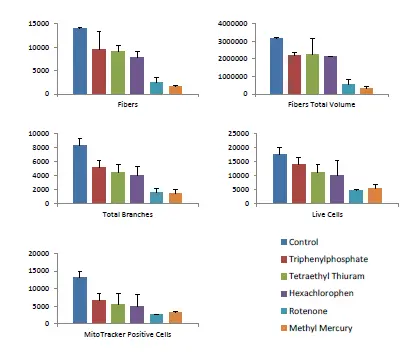
iCells 神経細胞を図2のように培養し、神経毒性を示す化合物で5日間処理した。3D解析による様々な測定値について、10μM濃度の効果を示す。神経突起(線維)と分岐点の数と体積を3D空間で検出し、カウントした。さらに、全細胞数、カルセインAM陽性「生きた」細胞数、ミトトラッカーオレンジ陽性細胞数を3Dでカウントし、特徴付けた。神経突起(線維)の数と総量、分岐点の数、総細胞数、生細胞数、MitoTracker Orange陽性細胞数に対する化合物の定量的効果を示す。
オルガノプレートを用いた3D神経毒性アッセイ
表現型の読み出しには、マルチプレックス測定による3Dでの神経ネットワークの広がりと複雑さの定量的特性評価が含まれる。この神経細胞モデル系では、アッセイの再現性を評価し、多重測定の特徴を明らかにし、いくつかの既知の神経毒性化合物をテストした。これらの解析手法により、神経突起ネットワークの複雑性に対するこれらの化合物の濃度依存的阻害効果を正確に測定した。したがって、この提案手法は、神経毒性を予測するためのハイスループットでハイコンテントな化合物スクリーニングに用いることができる。
結論
我々は、MIMETAS OrganoPlates®を用いた3D神経細胞培養の生存率と形態に対する治療効果のハイスループットな表現型評価を可能にする定量的共焦点ハイコンテントイメージング法を開発した。共焦点イメージングとマルチパラメトリック3D解析により、神経突起の計数と特性解析が可能になり、3Dにおける神経突起の発達と分岐の統計的特性解析も行える。解析手法により、神経細胞ネットワークの特性解析が可能になり、EC50値の定義や選択化合物の毒性効果の比較に使用できる定量的測定値が得られる。
参考文献
- Chang, TT; Hughes-Fulford, M (2008). ヒト肝肝細胞癌細胞株セルの細胞単層培養とスフェロイド培養は、異なるグローバル遺伝子発現パターンと機能的表現型を示す。Tissue Eng Part A. 15(3): 559-567
- Kunz-Schughart, LAら (2004). ハイスループットスクリーニングのための3次元培養の利用:多細胞スフェロイドモデル。J Biomol. Screen. 9(4): 273-285
- Trietsch, SJ et al. 成層3D細胞培養用マイクロ流体タイタープレート。Lab Chip. 13: 3548-3554
- Van Duinen, Vら(2015)。マイクロ流体3D細胞培養:ツールから組織モデルへ。Curr. Opin. Biotechnol. 35: 118-26
- Sirenko, O et al. Human iPSCDerived Neuronal Culturesの生存率と形態を評価するためのハイコンテントハイトスループットアッセイ。Assay and Drug Dev. Technologies.12(9-10): 536-47
- Vulto, P et al. Phaseguides: a paradigm shift in microfluidic priming and emptying. Lab Chip. 11: 1596-1602
- Wevers, NR et al. マイクロ流路プラットフォームにおけるニューロンとグリアの3Dネットワーク上でのハイスループット化合物評価。Sci. Rep.
ImageXpress®マイクロコンフォーカルハイコンテントイメージングシステムについて詳しくはこちら >>
PDF版(英語)