Application Note GrowDex-Tハイドロゲルを用いて3次元培養した膠芽腫細胞株から、
がん幹細胞をハイコンテントで定量した。
- 癌幹細胞を研究するためのU-251 MG細胞株をベースとしたスケーラブルなハイコンテントアッセイの検討
- GrowDex-T透明ハイドロゲルを用いて、HTSおよびHCSアプリケーションのイメージングに最適化された高品質の画像を取得する。
- ImageXpress®マイクロ共焦点システムを用いた正確な3D体積測定
PDF版(英語)
はじめに
Yiming Meng | Research Scientist | University of Reading, UK
Jonathan Sheard, PhD | Applications Scientist | UPM Biomedicals
Andy Bashford, PhD | Applications Scientist | Molecular Devices
細胞モデルを3Dで培養することには、より生体内に近い細胞環境を再現できるという利点がある。この生理学的妥当性の向上とともに、使いやすさ、再現性、処理時間、試薬コスト、アッセイの柔軟性、ハイスループットでのアッセイ自動化能力など、生物学的複雑性と実験的複雑性のバランスをとるための様々な考慮事項が生じる。どのようなモデルにおいても重要な要素は、セルを3Dで増殖・成熟させるための材料の選択である。
GrowDex®ハイドロゲルは、ナノフィブリルセルロースで構成されており、温度安定性が高く、ゲル調製の必要なくすぐに使用できる、明確で再現性の高いハイドロゲルとして特徴づけられる。この材料は細胞外マトリックス(ECM) を模倣しており、細胞が3Dで相互作用できるような支持層を提供すると同時に、 栄養素のような低分子の拡散を可能にする1,2。GrowDexハイドロゲルは剪断減粘性材料であり、静止状態では粘性のあるハイドロゲルであるが、ピペッティングや注入時に剪断応力がかかると流動性を持つようになる。多くの3Dスキャフォールド材料は可視光の散乱や吸収を引き起こし、イメージング用途には適していません。GrowDex®-Tはハイドロゲルの透明バージョンで、イメージングの質を向上させ、ハイコンテントスクリーニングアッセイに魅力的な選択肢となる3。
ここでは、ヒト膠芽腫細胞株U-251 MGの幹細胞性を調べるための3Dアッセイについて述べる。癌幹細胞(CSC)理論では、自己複製を行う少数の細胞集団が腫瘍を維持し増殖させるというモデルが提唱されている4。U-251 MG細胞は、がん幹細胞のような性質を示し5,6、容易に入手可能な細胞株であり、増殖やその後のスクリーニング研究に適している。われわれは、これらの細胞を3Dスフェロイドに成長させ、固定し、CSCマーカーであるネスティン7を標識する方法を示す。その後、ImageXpress® Microハイコンテントイメージングシステムを用いたハイコンテントイメージングとCSC集団の3Dの体積測定により、3Dモデルにおけるがん幹細胞の生物学的研究に有用かつ関連性の高いハイスループットなアッセイを実証する。
材料
- U-251 MG細胞(旧名U-373 MG)(ECACC cat.)
- 増殖培地 DMEM 高グルコース、2mM L-グルタミン、10% FCS、1% B27、20ng/ml EGF、20ng/ml FGF
- GrowDex-T ハイドロゲル(UPM Biomedicals, cat.)
- Greiner 96ウェルマイクロプレート、μClear® (Greiner、cat. #655096)
- 4%パラホルムアルデヒド(PFA)
- リン酸緩衝生理食塩水(PBS)
- 0.1%トリトンX-100含有リン酸緩衝生理食塩水(PBS-トリトン)
- 0.02%アジ化ナトリウム含有リン酸緩衝生理食塩水(PBS-アジド)
- ブロッキングバッファー: リン酸緩衝生理食塩水、0.02%Tween、5%ヤギ血清
- PBSで希釈した4′,6-ジアミノ-2-フェニルインドール二塩酸塩(DAPI)(1:2000)(Sigma-Aldrich)
- PBS(0.2nM、1:100)で希釈したファロイジン-Atto 550(Sigma-Aldrich)
- Nestin マウスモノクローナル抗体(1:250 ブロッキングバッファー希釈)(R&D Systems, #196908)
- ヤギ抗マウス Alexa Fluor 488(1:300ブロッキングバッファー希釈)(Invitrogen社製)
- ImageXpressマイクロコンフォーカル、4X Plan Apo Lambda対物レンズ、40X WI CFI Plan Apochromat水浸対物レンズ、レーザー光源、深部組織透過共焦点ディスクモジュール搭載。3Dボリューメトリックツールを備えたカスタムモジュールエディター。
方法
- 2D培養の準備: U251細胞を2D培養し、10% CO 2、37℃でインキュベートした。トリプシン処理後、細胞を1x107 cells/mLの濃度で完全培地に懸濁した。
- セル-ハイドロゲルの調製: 0.2%GrowDex-Tハイドロゲル中に1x106細胞/mLを含むワーキングセル溶液を作製し、96ウェルプレートの各ウェルに50μLずつプレーティングした(図1A)。700μLの完全培地に200μLのGrowDex-Tハイドロゲルを加え、気泡を避けながらピペッティングで十分に混合し、1mL容量の作業細胞溶液を作成した。次に、1x10 7 cells/mLの濃度で懸濁したセル100μLを加え、十分に混合した。96ウェルプレートに添加後、ハイドロゲル中の細胞を37℃で30分間静置し、50μLの標準培地を上から添加した(図1A)。
- 3D培養成長: 細胞を37℃、10% CO 2で72時間培養した。培地は培養期間の途中で1回交換した。この培地交換と、以下に述べるその他の固定/洗浄/染色工程は、以下のように行った: 50μLの上清を、ハイドロゲルを乱さないように注意深くウェルの端のメニスカスから除去した。50μLの新鮮な培地/PBS/PFAを、ピペットをウェルの端に当て、液体をゆっくり加えながらウェルに加えた。
- スフェロイドの固定: 培地をハイドロゲル層を乱さないように注意深く除去し、4%PFAをウェルに20~30分間注意深く加え、PBSで5分間2回静かに洗浄した。
- スフェロイド染色: 固定したスフェロイドをブロッキングバッファー中で30分間インキュベートした後、ネスチン一次抗体でインキュベートした。スフェロイドをPBSで穏やかに洗浄し、Alexa Fluor二次抗体でインキュベートした。すべての洗浄とインキュベーションは、4℃で一晩穏やかに攪拌しながら行った。スフェロイドをPBS-Tritonで30分間洗浄した後、PBSで5分間洗浄し、DAPIとファロイジン染色で4℃で一晩インキュベートした。染色後、サンプルをPBSで一晩洗浄し、PBS-アジドに移してイメージングに備えた。
- イメージングと解析:96ウェルプレートをImageXpress® Micro Confocalシステムを用いてイメージングした。QuickIDターゲット画像取得は、DAPIチャンネルを使用し、4倍の倍率で取得した単一視野で使用した。スフェロイドはサイズ、形状に基づいて自動的に選択され、その後高倍率で撮像された。画像は、DAPI、FITC、TRITCチャンネルで、5μmのステップサイズで25ステップのZ-スタック画像取得を行った。
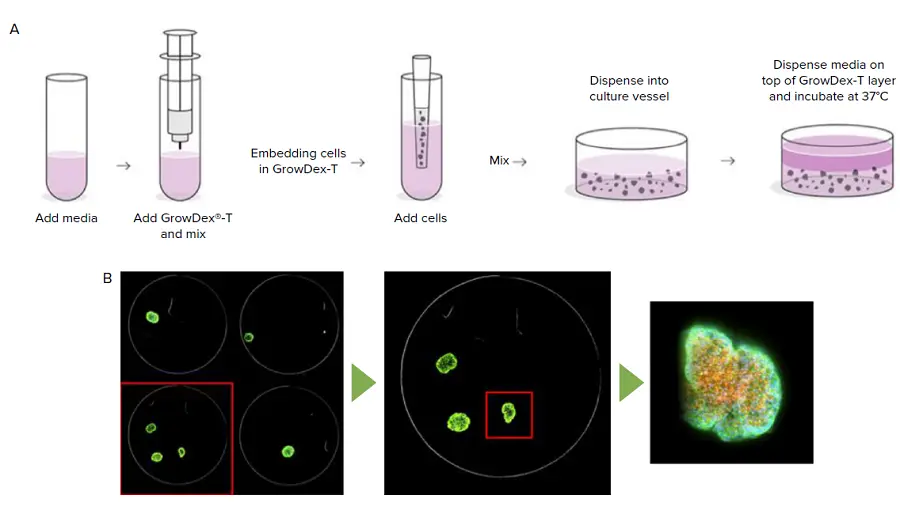
***図1.
方法の概要 GrowDex-T陰イオン性ナノフィブリルセルロース(aNFC)は、細胞培養液で希釈した後、セルを加え、96ウェルプレートにプレーティングすることにより調製される(A)。QuickIDターゲット画像取得の例で、低倍率での構造同定と高倍率での取得を示す(B)。
結果
GrowDex-Tハイドロゲルで培養した3DスフェロイドにおけるCSCマーカーの取得
U-251MGセルを、異なる細胞シグナリング経路を標的とする化合物を添加しながら3D培養した。ここでは、ImageXpress® Micro Confocalシステムを用いて、スフェロイドをハイスループットかつハイコンテントで研究するために用いたアッセイコンセプトを概説する。完全な結果と化合物の効果については、別途発表する予定である。
培養72時間後、3DスフェロイドはGrowDex-Tハイドロゲル全体に分布し、ゆるく不規則な形状で、周囲のマトリックスへの著しいアウトグロースを示した(図2A)。スフェロイド全体にネスチン陽性セルが明瞭に確認され、いくつかのネスチン陽性セルは3D構造内に小さな突起を伸ばしていた(図2B)。ファロイジンで標識されたフィラメント状アクチンは、スフェロイド全体に点状染色の明瞭なクラスタを伴って確認できる(図2C)。
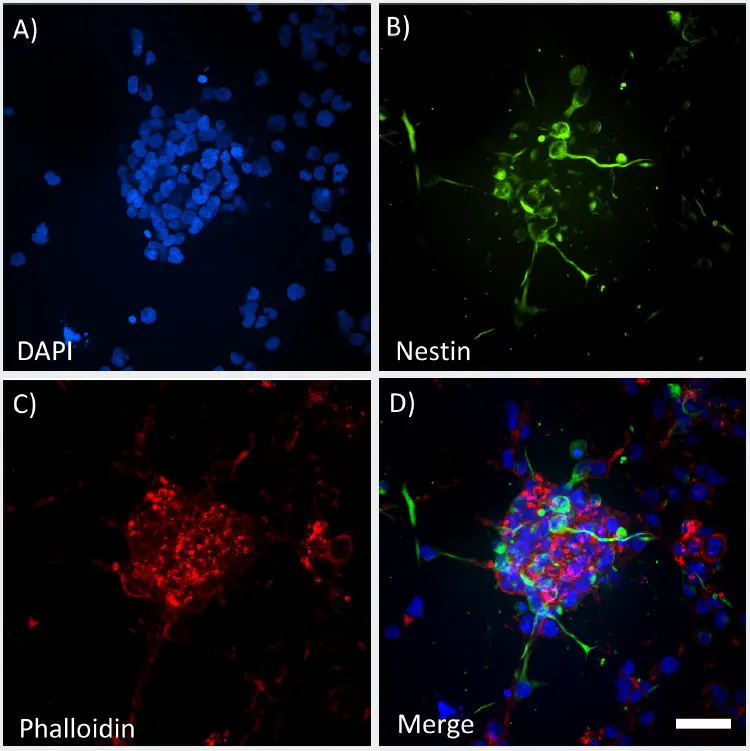
***図2
GrowDex-Tで培養した3Dスフェロイドの高鮮明度画像。ImageXpress Micro Confocalで40X水浸CFIアポクロマートLWDラムダSを用いて取得した最大プロジェクション画像。Z-スタックは120μm(20 x 5μmステップサイズ)。固定したスフェロイドをDAPI(A)、ネスチン(B)、ファロイジン(C)で標識し、全チャンネルをマージした(D)。スケールバー=50μm
スフェロイドはウェルの底から100~200μmの位置に置き、40倍の水浸レンズを用いて画像化した。ロングワーキングディスタンス(LWD)レンズにより、深さ120μmをカバーするZ-スタック画像で構造全体を取得した。最大250μmのGrowDex-Tハイドロゲルを通して撮像したにもかかわらず、スフェロイド構造を明瞭に可視化する鮮明度の高い画像が得られた。
このセットアップは、U-251細胞を3Dハイドロゲル中で増殖させ、スフェロイド構造の部分集団にのみCSCマーカーを発現させる方法を示している。これは、CSCsの行動や生理をハイスループットまたは自動化された方法で研究できる方法を示している。
QuickIDターゲット画像取得による効率化
複雑な3D細胞培養における画像取得の一般的な課題は、ウェル内の適切な構造とその位置を特定することである。このアッセイでは、QuickIDターゲット画像取得を使用して、最初の4倍の低倍率スキャン(図3A)に続いて、40倍の高倍率取得(図3B)を行った。この機能により、システムはスフェロイドを各視野の中心に自動的に配置することができた。低倍率画像におけるスフェロイドの検出にはカスタムモジュールエディターの機能が使用され、サイズ、形状、位置、強度などの測定値に基づいて、関心のある構造を偏りのない方法でフィルタリングすることができる(図3A)。
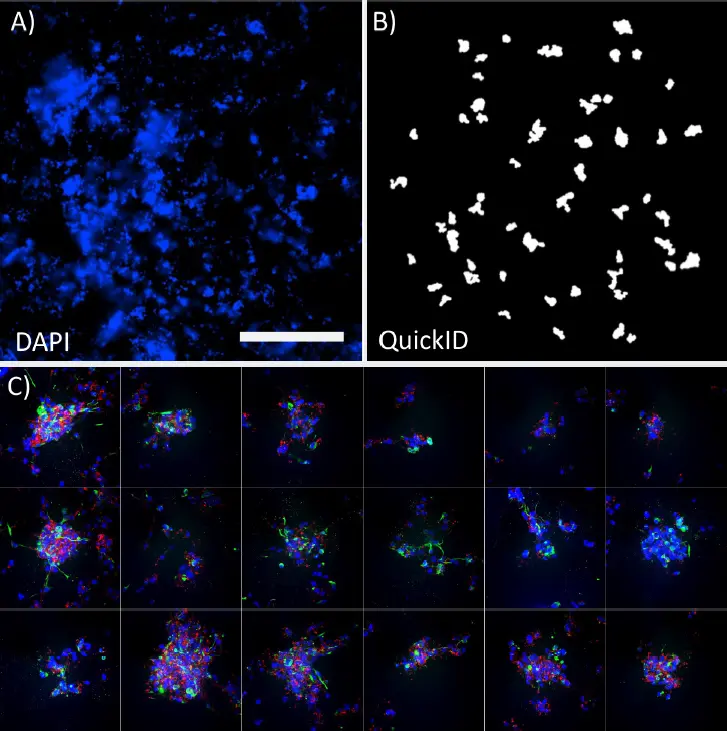
***図3.*
QuickIDワークフロー。DAPI標識スフェロイドの低倍率4倍画像(A)と、それに対応する高倍率スキャン用QuickID対物レンズ検出(B)。各視野の中心に正確に配置されたスフェロイドを示す高倍率(40倍)画像のパネル。スケールバー=1mm。
ターゲットを絞った撮影プロトコルを使用することで、ハイコンテント撮影を非常に効率的に行うことができ、水浸対物レンズに完全に適合する方法で、撮影時間と保存スペースを最小限に抑えることができた。この例では、QuickIDをDAPIチャンネルのみに使用したが、この最初のスキャンは対物レンズ検出のためにマルチチャンネルまたは透過光に簡単に拡張することができた。このアプローチにより、40倍の倍率で最大限の画質が得られ、構造物を視野の中央に正確に位置づけることができ、構造物の可視化と解析が向上した。
カスタムモジュールエディターでの体積解析ツールの活用
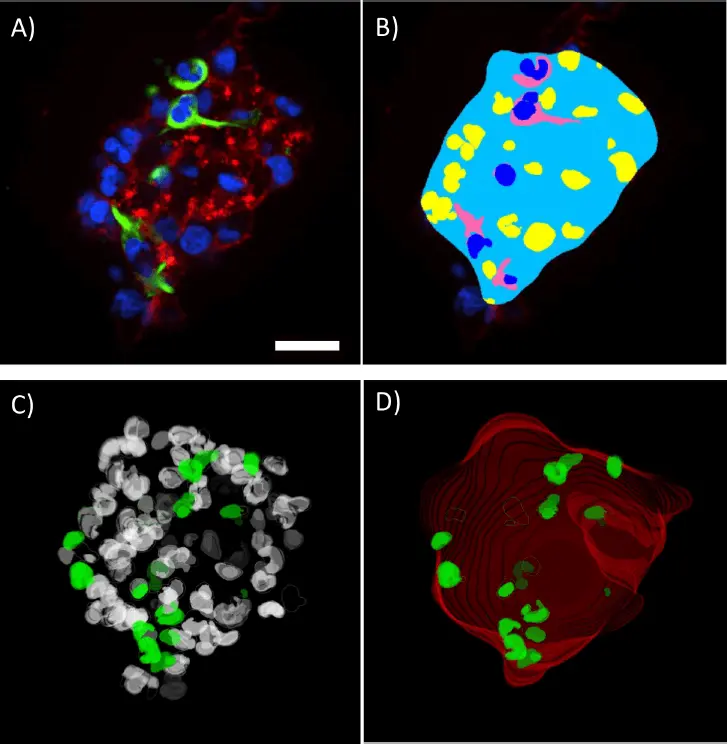
高倍率でのスフェロイドの定量化は、カスタムモジュールエディターで利用可能な3D解析ツールを使って完了した(図4 A,B)。スフェロイド全体の輪郭を検出するマスクは、ファロイジン染色を用いて作成した。全細胞集団はDAPI核染色を用いて検出し、ネスチン陽性細胞質は細胞を陽性または陰性としてスコア化できるように検出した。これらのマスクはすべて3Dで作成され、3Dビューアーを使ってマスクの3Dレンダリングを作成し、表示し、回転させることで、その精度が検証された(図4 C,D)。
| 測定 | スフェロイド |
|---|---|
| スフェロイド体積 | 612640 μm3 |
| スフェロイド直径 | 135 μm |
| スフェロイドの深さ | 85 μm |
| スフェロイドの深さ | 85 μm |
| スフェロイドあたりの総セル数 | 136 |
| ネスチン陽性セル数 | 25 |
| スフェロイドの深さ | 85 μm |
| スフェロイドあたりのネスチン陽性細胞の割合 | 18% |
| ネスチン陽性体積 | 25176 μm3 |
| 陽性セル間の平均距離 | 15.9 μm |
***図4.
スフェロイドの3Dの体積測定。DAPI、ネスチン、ファロジンで標識したスフェロイドの単一Z平面(A)とカスタムモジュールエディターで作成した対応する解析マスク(B)。全細胞集団(白)とネスチン陽性核(緑)を示す3Dの体積測定核マスク(C)。スフェロイド全体の輪郭(赤色)とネスチン陽性核(緑色)のボリュームレンダリングを示すスフェロイド輪郭マスク(D)。表示されたスフェロイドから定量化した測定値(E)。スケールバー=30μm
スフェロイドの形態学的測定には、体積、深さ、直径が含まれる(図4E)。スフェロイド中のネスチン陽性セルとその体積の定量も可能であり、周囲のネスチン陰性セル集団と比較することができた。これはCSC集団の定量化の一例であり、スフェロイドごとに自動的に定量化できるものである。
結論
我々は、U-251 MGスフェロイドのCSC集団を評価する3Dアッセイを実証した。細胞はGrowDex-Tハイドロゲル中で培養され、低分子の拡散と高画質画像の撮影を可能にしながら、構造体が成長するための3Dサポートを提供した。
ハイループットスクリーニングに適した3Dハイコンテントアッセイを開発するには、生理学的な複雑さと、再現性、使いやすさ、自動化への適合性といった実験的要素とのバランスを慎重に考慮する必要がある。GrowDex-Tハイドロゲルは、作業しやすく、信頼性の高いアッセイ開発手段を提供する、細胞のための明確な支持体を提供した。重要なことは、光学的透明度の高いハイドロゲルとImageXpress® Micro Confocalシステムとの組み合わせにより、各スフェロイド内のCSC集団全体を測定するための高鮮明度画像の取得が可能になったことである。
MetaXpress®ハイコンテント画像取得・解析ソフトウェアを使用することで、QuickIDターゲット画像取得と3Dの体積測定による高効率な画像取得が可能となり、スフェロイドの形態とCSC集団を定量化することができた。このアッセイは、膠芽腫細胞株におけるCSC生物学を制御する因子または化合物の研究に適した、スケーラブルなハイコンテントアッセイである。
参考文献
- Malinen, Melina Mら. "3Dナノフィブリルセルロースおよびヒアルロン酸-ゼラチンハイドロゲルにおける肝前駆細胞株の機能的器官型培養への分化". Biomaterials 35,19 (2014): 5110-21. doi:10.1016/j.biomaterials.2014.03.020
- Lou, Yan-Ru et al. "The use of nanofibrillar cellulose hydrogel as a flexible three-dimensional model to culture human pluripotent stem cells.". Stem cells and development 23,4 (2014): 380-92. doi:10.1089/scd.2013.0314
- Sheard, Jonathan J. et al. "Optically Transparent Anionic Nanofibrillar Cellulose Is Cytocompatible with Human Adipose Tissue-Derived Stem Cells and Allows Simple Imaging in 3D.". ステムセル・インターナショナル2019年3106929巻。2019.10.7, doi:10.1155/2019/3106929
- Prager, Briana C et al. "Cancer Stem Cells: 腫瘍エコシステムの建築家". セルステムセル24,1巻(2019): 41-53. doi:10.1016/j.stem.2018.12.009
- Cao, Xiangmei et al. "A new approach to screening cancer stem cells from the U251 human glioma cell line based on cell growth state.". オンコロジー・レポート29,3巻(2013年): 1013-8. doi:10.3892/or.2012.2206
- Zhang, Suojun et al. "Identification of U251 glioma stem cells and their heterogeneous stem-like phenotypes.". オンコロジー・レターズ6,6巻(2013年): 1649-1655. doi:10.3892/ol.2013.1623
- Neradil, Jakub, and Renata Veselska. "がん幹細胞のマーカーとしてのネスチン". がん科学106,7巻(2015):803-11.
PDF版(英語)